Analgesia e Sedação
A analgesia e a sedação são pilares da terapia intensiva. Dor, ansiedade, agitação, desconforto e insônia são disfunções apresentadas pelos pacientes internados em centros de terapia intensiva (CTIs) de todo o mundo. Fornecer conforto e bem-estar ao paciente grave é um dever do médico. O uso das medicações analgésicas está amplamente difundido no dia a dia de todo plantonista de CTI. Deve-se conhecer, entretanto, o melhor meio de aplicar os conceitos de farmacologia para utilizar as medicações da maneira mais adequada possível.
A analgesia desempenha papel fundamental na terapia intensiva. O paciente crítico tem como companhia dor e desconforto decorrentes tanto de procedimentos cirúrgicos ou clínicos invasivos, como também de uso de medicações, infusões, aspiração de vias aéreas, cuidados de enfermagem, ventilação mecânica, drenos e suportes de monitorização.
Ademais, deve-se sempre recordar que se trata de um paciente restrito ao leito. A dor produz desequilíbrio do bem-estar, com alteração direta do ritmo de sono, estado hiperdinâmico, má adaptação respiratória, febre, agitação e desorientação. A avaliação da dor deve ser rotineira e diária. A analgesia não deve ser poupada.
Avaliação da dor
Sempre avalie a intensidade da dor e a resposta do paciente à terapêutica administrada.
Escala de avaliação numérica (
Numeric Rating Scale
[NRS])
-
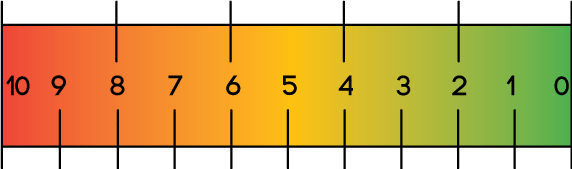
Um dos instrumentos mais simples é a escala numérica, que gradua de 0 (ausência de dor) até 10 (a pior dor já sentida). Nesse caso, considera-se:
- Dor leve: até o valor 2;
-
Dor moderada:
3-7;
- Dor intensa: 8-10.
Atenção! Uma pontuação < 3, após a administração do fármaco, sugere sucesso no tratamento, respeitando-se o tempo esperado de ação da medicação empregada.
Em casos de pacientes em vigência de sedação profunda a avaliação na escala previamente descrita fica comprometida sendo uma outra ferramenta importante a escala comportamental de dor (
Behavorial Pain Scale
[BPS]).
Escala Comportamental de Dor ( Behavorial Pain Scale [ BPS])
-
Expressão facial:
- Relaxada: 1;
- Contraída parcialmente: 2;
- Contraída totalmente: 3;
- Careta/expressão facial de dor: 4.
-
Avaliação dos membros superiores:
- Sem movimentos: 1;
- Parcialmente flexionados: 2;
- Flexão completa (inclusive dedos): 3;
- Totalmente retraídos: 4.
-
Adaptação à ventilação mecânica:
- Tolerância adequada: 1;
- Tosse, porém sem perder a tolerância: 2;
- Mal adaptado à ventilação mecânica ("briga"): 3;
- I ncapacidade de adaptar-se à ventilação mecânica: 4.
A escala BPS, quando soma > 5, é indicação definitiva de analgesia. A maior controvérsia envolvendo essa escala é que os pacientes que mais se beneficiariam de sua aplicação seriam os mais sedados e, sendo assim, dificilmente pontuariam.
Abordagem Terapêutica
-
Opções terapêuticas:
- Para pacientes com dor leve a moderada, o primeiro degrau é usar um fármaco não opiáceo, com adição de um adjuvante, conforme a necessidade. Analgésicos simples e anti-inflamatórios são os de primeira escolha;
- Anti-inflamatórios devem ser utilizados com cautela em pacientes graves com comorbidades pelo risco de eventos adversos como injúria renal aguda e sangramento gastrointestinal;
-
Se essa estratégia não obtiver resultado, adiciona-se um opioide fraco;
- Se a combinação de opiáceo fraco com o não opiáceo também não for efetiva no alívio da dor, substitui-se o opioide fraco por um mais forte;
-
Sugere-se titular um agente analgésico, administrando-se a dose efetiva mínima conhecida do agente de escolha (preferencialmente por VO), além de observar a resposta do paciente (conforme as propriedades farmacocinéticas). Instituir a dose do fármaco em que se obteve efeito satisfatório como fixa (regular) e indicar doses de resgate (com um fármaco mais potente) para avaliações de ajuste posteriores;
-
Na necessidade de opioides, fazer esquema de rodízio, calculando a dose diária total de analgésicos nas 24 horas, incluindo as doses de resgate. Definir uma dose de manutenção, dividir a dose diária total pelo número de vezes que serão administradas em um dia e prescrever as doses de resgate;
-
Pacientes recebendo analgesia regular (com horário preestabelecido) também devem sempre ser providos de “dose resgate” de analgésicos. Nesse caso, nunca usar um opiáceo fraco como resgate de um opioide forte.
-
Medicações mais utilizadas (adultos):
-
Analgésicos comuns:
- Paracetamol (300 mg/3 mL) 500-1.000 mg VO a cada 4-6 horas (dose máxima: 6 g/dia);
- Dipirona sódica (500 mg/mL) 500-1.000 mg VO/EV de 6/6 horas (dose máxima: 6 g/dia);
-
Anti-inflamatórios não esteroidais (AINEs):
- Ibuprofeno (600 mg/comprimido) 200-600 mg VO a cada 4-6 horas;
- Diclofenaco (75 mg/1 mL) 50-100 mg VO/EV a cada 6-8 horas (dose máxima: 200 mg/dia);
- Naproxeno (250 mg/comprimido) 250-500 mg/dose VO 2x/dia;
- Indometacina (25 mg/comprimido) 25-50 mg/dose VO 3x/dia;
- Cetoprofeno (100 mg/frasco) 50-100 mg VO/EV de 8/8 horas (dose máxima: 400 mg/dia);
- Piroxicam (40 mg/2 mL) 20-40 mg VO/EV 1x/dia;
- Colecoxibe (100-200 mg/comprimido) 100 mg VO 2x/dia;
- Etoricoxibe (60 mg/comprimido) 60-90 mg VO/EV 1x/dia;
- Tenoxicam (20 mg/2 mL) 20-40 mg VO/EV 1x/dia (dose máxima: 40 mg/dia);
- Nimesulida (100 mg/comprimido) 50-100 mg VO de 12/12 horas;
- Meloxicam (15 mg/1,5 mL) 7,5-15 mg VO/EV a cada 12-24 horas.
-
Relaxantes musculares:
- Carisoprodol (125 mg/comprimido) 125-150 mg VO 3-4x/dia;
- Cloridrato de ciclobenzaprina (5 mg/comprimido) 20-40 mg/dia em 2-4 doses (dose máxima: 60 mg/dia);
- Baclofeno (10 mg/comprimido) 15 mg/dia em 2-4 tomadas.
-
Dor crônica refratária:
- Fosfato de codeína (30 mg/comprimido) 30-60 mg VO até de 4/4 horas;
- Cloridrato de tramadol (50 mg/comprimido) 50-100 mg VO até de 6/6 horas (dose máxima: 400 mg/dia); opção EV (dose máxima: 600 mg/dia);
- Oxicodona (10 mg/comprimido) 10-30 mg VO de 12/12 horas;
- Fentanila transdérmica (4,2 mg/adesivo) 1 adesivo a cada 48-72 horas;
- Metadona (5 mg/comprimido) 2,5-10 mg VO a cada 3-4 horas (dose máxima: 120 mg/dia);
- Morfina (10 mg/comprimido). Dose inicial: 5-10 mg VO de 4/4 horas. Dose usual: 15-30 mg VO de 4/4 horas;
- Meperidina (100 mg/2 mL) 50-100 mg SC 1-3x/dia;
- Morfina (10 mg/1 mL) 50 mg (5 mL) + 95 mL de SF 5%. Concentração: 0,5 mg/mL. Administrar EV, iniciando com 2 mL/hora, em BIC, até o limite máximo de 20 mL (10 mg) em 4 horas;
- Fentanila (100 microgramas/2 mL) 50 microgramas EV em bólus diluídos em SF 0,9%;
- Fentanila (500 microgramas/10 mL) 2 mg (40 mL) + 160 mL de SF 0,9%. Concentração: 10 microgramas/mL. Administrar EV, iniciando com 0,25 mL/hora (2,5 microgramas/hora), em BIC, até o limite máximo de 20 mL (200 microgramas) em 4 horas;
- Na possibilidade de analgesia epidural: Fentanila (500 microgramas/10 mL) 20 mL + Bupivacaína 0,5% 40 mL + 140 mL de SF 0,9%. Concentração: 5 microgramas/mL. Administrar dose inicial de 15 microgramas (3 mL) seguida de infusão contínua a 3 mL/hora até o limite máximo de 20 mL (100 microgramas) em 4 horas.
-
Dor neuropática:
- Amitriptilina (25 mg/comprimido) 25-100 VO mg/dia;
-
Nortriptilina
(10 mg/comprimido) 10-50 mg/dia (idosos) ou até 150 mg/dia (adultos) VO;
-
Carbamazepina
(200 mg/comprimido) 200 mg/dia VO;
-
Gabapentina
(300 mg/comprimido) 300-1.800 mg/dia VO em 3 doses (inicial: 3 x 300 mg);
- Imipramina (25 mg/comprimido) 25-75 mg VO à noite.
-
Monitorização do tratamento:
A avaliação do grau de debilidade do paciente, sobretudo no contexto de cuidados paliativos, pode ser facilitada pela utilização da escala
Performance Status
(PS)
, conforme o estado geral do paciente:
- PS 0: Atividade normal com relação ao que realizava antes da doença;
- PS 1: Enfrenta sintomas da doença, mas deambula e mantém atividades diárias;
- PS 2: Consegue ficar fora do leito mais de 50% do dia e realizar alguma atividade;
- PS 3: Restrito ao leito > 50% do dia, dependente de cuidados relativos;
- PS 4: Acamado, restrito ao leito, dependente de cuidado contínuo.
-
Equivalência: Doses equianalgésicas (EV → VO):
- Morfina 10 mg EV = 30 mg VO;
- Buprenorfina 0,3 mg EV = 0,4 mg VO (SL);
- Codeína 100 mg EV = 200 mg VO;
- Hidromorfona 1,5 mg EV = 7,5 mg VO;
- Petidina 100 mg EV = 300 mg VO;
- Metadona 1 mg EV = 3 mg VO;
- Oxicodona 10 mg EV = 20 mg VO;
- Oximorfona 1 mg EV = 10 mg VO;
- Tramadol 100 mg EV = 120 mg VO.
-
Objetivos:
- Melhora da sincronia com a ventilação mecânica;
- Diminuição do consumo de oxigênio;
- Tratamento de distúrbios psiquiátricos ou problemas relacionados com abstinência de substâncias de abuso;
- Restauração da temperatura corporal;
- Alívio da ansiedade, indução do sono e de eventual amnésia;
-
Redução do metabolismo basal.
Em casos de traumatismo cranioencefálico (TCE), a sedação pode favorecer a indução do coma e o consequente "silêncio elétrico", que reduz a demanda metabólica cerebral.
O estado de agitação psicomotora associada ao
delirium
é comum na terapia intensiva. Para esse grupo de pacientes, não está indicada a sedação profunda. O uso de antipsicóticos é o mais recomendado (ex.: Haloperidol [típico] ou Risperidona [atípico]).
A sedação pode incluir ou não a hipnose, sendo mensurada, frequentemente, pelas escalas de
Ramsay e Richmon Agitation-Sedation Scale (
RASS).
Avaliação e monitorização:
O uso da sedação deve cumprir seu papel, fundamentalmente oferecendo conforto ao paciente. O uso excessivo, desnecessário e prolongado pode conduzir a diversas complicações. O emprego por mais de 1x/dia de escala de monitorizações e a realização do despertar diário (para os pacientes hábeis, clinicamente estáveis e sob vigilância intensiva) são recomendações atuais da boa prática médica. Duas escalas se destacam nesse processo de avaliação: (1) Ramsay, a mais utilizada; e (2) RASS, a mais completa. A escolha das escalas fica a critério de cada serviço.
| Ramsay | Condição |
| I | Paciente acordado e agitado, ansioso ou inquieto |
| II | Paciente acordado e colaborativo |
| III | Paciente dormindo, despertável com estímulo verbal, responsivo a comandos |
| IV | Paciente dormindo, despertável com estímulo verbal vigoroso ou leve toque da glabela |
| V | Paciente dormindo, despertável com estímulo álgico leve (compressão glabelar) |
| VI | Paciente dormindo, sem resposta à compressão glabelar |
| RASS | Referência | Descrição da resposta |
| +4 | Combativo | Violento com risco para todos |
| +3 | Muito agitado | Remove monitorização, agride verbalmente |
| +2 | Agitado | Movimenta-se excessivamente, mal adaptado à ventilação mecânica |
| +1 | Inquieto | Movimenta-se não excessivamente, sem agressividade |
| 0 | Alerta e calmo | Tranquilo e acordado |
| -1 | Sonolento | Dormindo, porém desperta ao chamado com abertura ocular > 10 segundos |
| -2 | Sedação leve | Desperta ao chamado |
| -3 | Sedação moderada | Ao chamado, movimenta-se ou apresenta abertura ocular sem contato |
| -4 | Sedação intensa | Movimenta-se ou apresenta abertura ocular ao toque |
| -5 | Não desperta | Não responde a qualquer tipo de estímulo |
Abordagem Terapêutica
-
Planejamento da sedação:
-
Controlar causas reversíveis de agitação:
- Dor;
-
Hipoxemia;
-
Hipotensão;
-
Hipoglicemia;
-
Delirium.
-
Aperfeiçoar o ambiente:
- Controle do ruído;
-
Redução da exposição do paciente;
- Temperatura estável e adequada.
- Definir o objetivo da sedação e o fármaco de escolha;
- Documentar diariamente o nível de sedação;
- Ter como meta a redução diária da dose do sedativo;
- Pacientes com doses elevadas ou > 7 dias de sedação: reduzir 20-25% da dose diariamente;
- Acompanhar o padrão do sono e a presença de delirium para aplicação da terapêutica adequada;
- Protocolos de sedação: algoritmos para ajuste dos sedativos pela enfermagem com o intuito de manter o paciente em sedação superficial;
- Não sedação: opção por manter o paciente em analgesia e sedação de acordo com a necessidade apresentada e por curtos períodos;
-
Despertar diário: suspender a sedação pela manhã até o paciente apresentar algum despertar, incômodo ou indícios de má adaptação à ventilação mecânica (tosse, movimentos, fácies de dor). Em seguida, deve-se retornar à metade da dose e titulá-la conforme necessário;
- Alvo de sedação na maioria dos pacientes: RASS 0 a -2;
- Sedação profunda (RASS -5) indicada para pacientes com síndrome do desconforto respiratório agudo grave, estado de mal epiléptico refratário e hipertensão intracraniana.
-
Agentes sedativos – escolha ideal:
- Ação de início rápido e com curta duração;
-
Pouca interação com outras medicações;
-
Baixa toxicidade;
-
Baixo custo;
- Administração facilitada.
-
Medicações mais utilizadas (adultos):
-
Benzodiazepínicos:
Uso comum em terapia intensiva. Efeitos sedativo, ansiolítico e de amnésia que são revertidos com a administração de Flumazenil EV. São contraindicados após infusões prolongadas pelo risco de abstinência. Podem eventualmente causar hipotensão, dependência e indução de
delirium
. Apresentam ação sinérgica com opioides:
-
Midazolam
:
25-100 microgramas/kg em bólus EV seguidos por 0,25-1 micrograma/kg/minuto EV em bomba infusora.
-
Midazolam
:
25-100 microgramas/kg em bólus EV seguidos por 0,25-1 micrograma/kg/minuto EV em bomba infusora.
-
Opioides:
Auxiliam na sedação, pois proporcionam analgesia. Em geral, não produzem amnésia. Podem causar efeitos colaterais (redução da motilidade intestinal, bradicardia e depressão respiratória):
-
Fentanila
:
1-3 microgramas/kg em bólus EV seguidos por 0,01-0,03 micrograma/kg/minuto EV contínuo;
-
Alfentanila
:
10-25 microgramas/kg EV seguidos por 0,25-1 micrograma/kg/minuto EV contínuo.
-
Fentanila
:
1-3 microgramas/kg em bólus EV seguidos por 0,01-0,03 micrograma/kg/minuto EV contínuo;
-
Propofol:
Anestésico geral que apresenta efeito sedativo em doses menores. Utilizar com cuidado em pacientes com instabilidade hemodinâmica (risco de hipotensão). Fundamental no neurointensivismo, pois proporciona redução do metabolismo cerebral e da pressão intracraniana. O uso em altas doses (> 83 microgramas/kg/minuto) e por tempo prolongado (> 3 dias) pode causar a síndrome de infusão do Propofol (acidose metabólica, arritmias, hiperlipidemia e evolução para parada cardiorrespiratória), para a qual não há tratamento específico:
- Dose: 250-1.000 microgramas/kg em bólus EV seguidos por 10-50 microgramas/kg/minuto EV contínuo.
- Agonista alfa-2-central (Dexmedetomidina) : Utilizado como sedativo e analgésico com característica de despertar rápido, o que facilita a reavaliação neurológica. Não desencadeia depressão respiratória. Foi associado a menor tempo para extubação e menor índice de delirium . Pode desencadear bradicardia em altas doses (> 0,7 micrograma/kg/hora), além do risco teórico de hipotensão. A dose usual é de 1 micrograma/kg em bólus EV seguido por 0,2-0,7 micrograma/kg/hora EV;
-
Cetamina:
Anestésico dissociativo que produz estado de dissociação neurológica sem reação à dor ou ao chamado verbal (analgesia profunda e amnésia). Interage com diversos receptores, inclusive opioides e colinérgicos. Administrar com um benzodiazepínico a fim de evitar alucinações:
- Dose: 2-6 mg/kg IM ou 0,25-0,5 mg/kg EV seguidos por 0,5-1 mg/kg/hora EV contínuo.
-
Haloperidol:
Medicamento de escolha para o estado de agitação e
delirium
. Pode desencadear sintomas extrapiramidais. Em pacientes conscientes, a via de administração pode ser oral, desde que não haja risco de broncoaspiração. O uso intravenoso, apesar de questionável (potencializa a chance de efeitos adversos), é uma prática amplamente difundida no Brasil:
- Dose: 0,5-10 mg IM/EV – agitação leve a intensa seguidos por manutenção de 2-10 mg a cada 2-8 horas.
Medicações utilizadas principalmente para facilitar a intubação orotraqueal (ex.: intubação em sequência rápida), bem como em pacientes com síndrome do desconforto respiratório grave com assincronias. Sempre utilizar associado a sedativos e analgésicos para complementação dos efeitos.
Principais Opções Usadas na Prática Clínica
-
Succinilcolina:
- Bólus: 1-2 mg/kg EV;
-
Manutenção: não recomendada;
-
Efeito: 0,5-1 minuto;
-
Duração: 5-10 minutos;
-
Complicação: ação vagolítica e hiperpotassemia.
-
Atracúrio:
- Bólus: 0,5 mg/kg EV;
-
Manutenção: 11-13 microgramas/kg/minuto EV;
-
Efeito: 1,5-2 minutos;
-
Duração: 20 minutos;
-
Complicação: liberação histamínica.
-
Vecurônio:
- Bólus: 0,1 mg/kg EV;
-
Manutenção: 0,02-0,03 mg/kg/minuto EV;
-
Efeito: 2-3 minutos;
-
Duração: 25-30 minutos;
-
Complicação: menor potencial de liberação de histamina se comparado a outros bloqueadores.
-
Rocurônio:
- Bólus: 0,6 mg/kg;
- Manutenção: 0,3-0,6 mg/kg/hora EV;
-
Efeito: 1-1,5 minuto;
-
Duração: 20-40 minutos;
-
Complicação: raras porém podem ocorrer reações anafiláticas graves.
-
Na prática:
- Primeira escolha: Rocurônio, Vecurônio, Atracúrio e Cisatracúrio;
-
Intubação orotraqueal: Succinilcolina, Rocurônio;
-
Mais usado no CTI: Rocurônio e Cisatracúrio;
-
Asma grave ou uso por tempo prolongado: Rocurônio;
-
SARA: Cisatracúrio.
-
Reversão:
Pode ser obtida por fármacos anticolinesterásicos. Esquema recomendado:
- Neostigmina : 0,05 mg/kg EV;
-
Atropina
: 0,01 mg/kg EV.
-
Autoria principal:
Gabriela Queiroz (Anestesiologia).
-
Revisão:
- Mariana C. S. da Rocha (Anestesiologia);
- Yuri de Albuquerque (Medicina Intensiva).
Grecu L. ICU Analgesia and Sedation: Is It Time to Change Our Practice? Crit Care Med. 2023; 51(11):1600-1602.
Olsen HT, Nedergaard HK, Strøm T, et al. Nonsedation or Light Sedation in Critically Ill, Mechanically Ventilated Patients. N Engl J Med. 2020; 382(12):1103-1111.
Orhurhu V, Orhurhu MS, Bhatia A, et al. Ketamine infusion for cronic pain: A Systematic review of meta-analysis of randomized controlled trials. Anesth Analg. 2019; 129(1):241-254.
Devlin JW, Skrobik Y, Gélinas C, et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med. 2018; 46(9):e825-e873.
Vincent JL, Shehabi Y, Walsh TS, et al. Comfort and patient-centred care without excessive sedation: the eCASH concept. Intensive Care Med. 2016; 42(6):962-971.
Rabelo NN, Rabelo NN, Machado FS, et al. Critical Analysis of Sedation and Analgesia in Severe Head Trauma. Arq Bras Neuro. 2016; 35(2):135-147.
Bender BG. Pain control in the intensive care unit: new insight into an old problem. Am J Respir Crit Care Med. 2014; 189:9-10.
Barr J, Fraser GL, Puntillo K, et al. American College of Critical Care Medicine. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. 2013; 41:263-306.
Strøm T, Martinussen T, Toft P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial. Lancet. 2010; 375(9713):475-480
Sessler CN, Varney K. Patient-focused sedation and analgesia in the ICU. Chest. 2008; 133(2):552-565.