Controle da Dor
O controle da dor é um dos pilares do cuidado ao paciente. No contexto da unidade de terapia intensiva (UTI), isso é especialmente relevante, uma vez que mais de 50% dos pacientes se queixam de dor, com intensidade moderada a forte, durante a internação. Os procedimentos considerados mais dolorosos são: colocação de cateter de monitorização de pressão arterial invasiva, drenagem de tórax, aspiração traqueal, ventilação mecânica e reposicionamento no leito.
A dor é definida como “uma experiência sensorial e/ou emocional desagradável associada a dano tecidual real ou potencial, ou descrita em termos de tal dano”. A dor deve ser considerada “qualquer coisa” que a pessoa que a vivencia diz que é, existindo “sempre que” a pessoa que a vivencia diz que existe. Embora a medida padrão de referência da dor seja o autorrelato do paciente, a incapacidade de se comunicar claramente não nega a experiência de dor do paciente ou a necessidade de um tratamento adequado da dor.
A sensação da dor é multidimensional e não puramente "física". Além disso, é uma experiência subjetiva e individual de cada paciente. Pode ser exacerbada por fatores como: ansiedade, depressão, falta de apoio social, sensação de perda do controle sobre o próprio corpo durante a hospitalização e dificuldade de comunicação.
A avaliação inadequada da dor pode ocasionar sub ou superdosagem de analgésicos, o que afeta o desfecho dos pacientes. O controle inadequado da dor está associado a maior tempo de internação, maior necessidade de sedativos e aumento da incidência de
delirium
. Assim, deve-se ativamente avaliar a presença de dor nos pacientes, assegurando um controle adequado desse sintoma. No entanto, alguns pacientes possuem dificuldade para comunicação, o que representa uma barreira para essa avaliação.
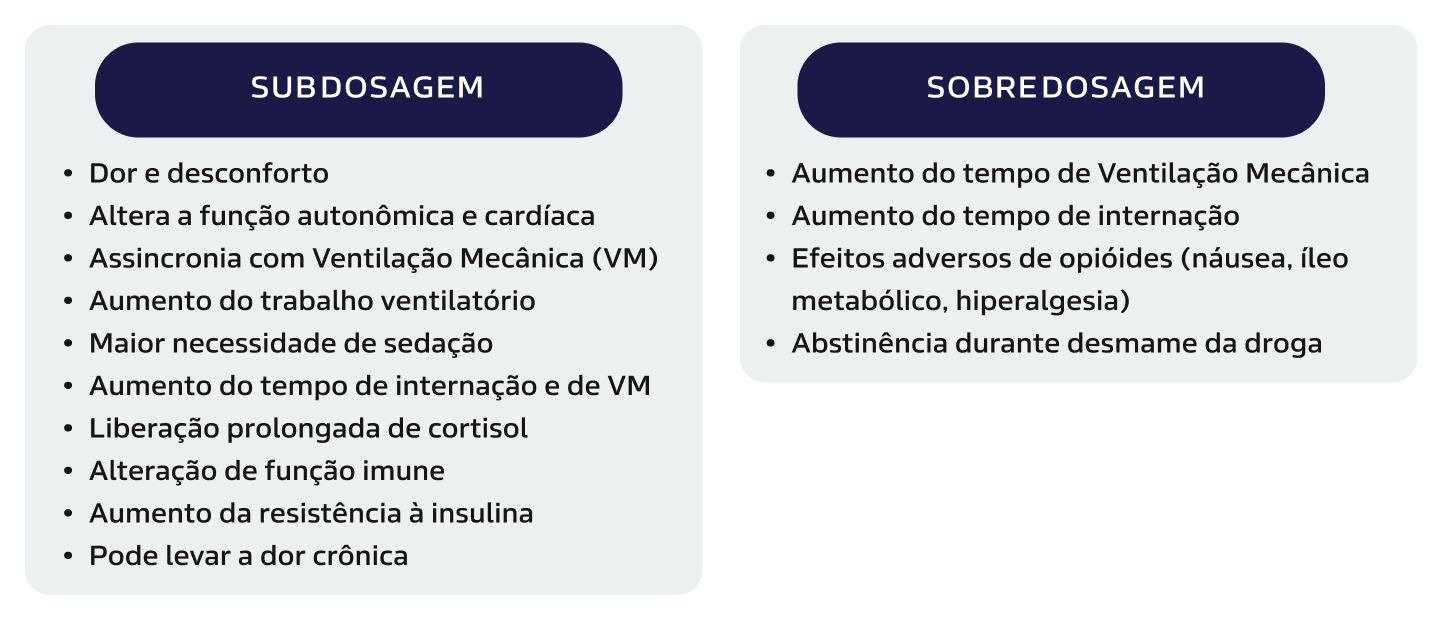 Figura 1:
Efeitos adversos com a Sub ou Sobredosagem de analgésicos.
Figura 1:
Efeitos adversos com a Sub ou Sobredosagem de analgésicos.
-
A dor deve ser avaliada quanto a:
- Localização;
-
Intensidade;
- Irradiação;
-
Tipo/qualidade/caráter;
-
Fatores de piora e de melhora;
- Duração;
- Periodicidade/recorrência;
- Tratamentos anteriores e resposta;
- Impacto da dor nas atividades diárias.
-
Na situação em que o paciente é incapaz de se expressar, além das escalas visuais, podem ser considerados o
relato e a opinião dos familiares
sobre a presença de dor ou o desconforto.
Essa ferramenta ainda não é formalmente validada em estudos científicos e, também, não exime a equipe multiprofissional de examinar ou aplicar escalas comportamentais de dor no paciente.
No entanto, é um meio de empoderar a família e valorizar sua participação no cuidado, o que pode fortalecer o vínculo de confiança entre a equipe de saúde e a família.
O paciente internado comumente é monitorizado por meio de diversos parâmetros, por exemplo: frequências cardíaca e respiratória, pressão arterial, saturação de oxigênio e capnografia.
Esses parâmetros fisiológicos, porém, não são indicadores válidos para acessar a presença de dor, por sua baixa especificidade, de modo que não devem ser utilizados de maneira isolada . Isso porque outros fatores podem causar alteração desses sinais vitais, como a presença de sepse ou desidratação.
Essas informações servem apenas como alertas de que o paciente pode apresentar dor, e devem incentivar a avaliação do paciente com perguntas diretas (autorrelato) ou aplicação de escalas comportamentais ( Behavioral Pain Scale [BPS] ou Critical-Care Pain Observation Tool [CPOT].
Com frequência, o paciente apresenta mais de um tipo ou localização da dor, de etiologias, em geral, distintas. Cada "dor" deve ser abordada individualmente, com anamnese distinta para esclarecer sua etiologia. Isso é fundamental pois a melhor abordagem para a dor depende de sua temporalidade (aguda
versus
crônica) e fisiopatologia (nociceptiva, neuropática, miofascial, nociplástica).
-
A dor é dividida em:
- Temporalidade: A dor aguda tem d uração < 3 meses. A dor crônica tem duração > 3 meses. Também é chamada de a cute-on-chronic a dor crônica com agudização dos sintomas;
-
Tipos:
A dor pode ser nociceptiva (somática ou visceral), neuropática, miofascial ou nociplástica:
- Dor nociceptiva: Essa categoria é caracterizada pela ativação de nociceptores em decorrência de lesões teciduais reais ou potenciais. É frequentemente associada a processos inflamatórios ou danos físicos, como queimaduras, fraturas ou artrite. A dor nociceptiva pode ser subdividida em somática (originada de estruturas como pele, músculos e ossos) e visceral (originada de órgãos internos);
-
Dor neuropática:
Resulta de lesões ou doenças que afetam o sistema nervoso somatossensorial. Exemplos incluem neuropatia diabética, neuralgia pós-herpética e dor radicular. A dor neuropática é frequentemente descrita como queimação, formigamento ou choque elétrico, e pode ser acompanhada por alodínia (dor causada por estímulos que normalmente não são dolorosos) e hiperalgesia (resposta aumentada a estímulos dolorosos);
-
Dor miofascial:
Síndrome de dor musculoesquelética caracterizada pela presença de pontos-gatilho miofasciais, que são áreas localizadas de hipersensibilidade dentro de bandas musculares tensas. Esses pontos-gatilho podem gerar dor local e referida, ou seja, a dor pode ser sentida em uma área distante do ponto-gatilho. Os pontos-gatilho são descritos como nódulos firmes e sensíveis que, quando palpados, provocam dor irradiada e uma resposta de contração muscular local;
- Dor nociplástica: Esse termo foi introduzido para descrever a dor que surge de uma nocicepção alterada, sem evidência clara de dano tecidual ou lesão nervosa que explique a intensidade da dor (ex.: fibromialgia e cefaleia tensional). A dor nociplástica é frequentemente associada a sensibilização central, em que há amplificação da percepção da dor no sistema nervoso central (SNC) e pode coexistir com dor nociceptiva ou neuropática.
A avaliação prática da dor pode ser feita de diversas formas, incluindo o autorrelato do paciente ou o uso de escalas padronizadas.
O
autorrelato
de dor de um paciente é o padrão de referência para avaliação de dor em pacientes que podem se comunicar de maneira confiável. Entre pacientes críticos adultos que são capazes de se comunicar, a escala de avaliação numérica (
Numeric Rating Scale
[NRS]), de 0-10, administrada verbal ou visualmente, é uma escala de dor validada.
-
A avaliação da dor em pacientes que não conseguem se comunicar é um desafio. Esses estão sob maior risco de apresentar dor "não reconhecida" e receber tratamento insuficiente. Os pacientes podem ter dificuldades diferentes para se comunicar, com espectros de limitação diversos. Alguns apresentam dificuldades permanentes para comunicação, por exemplo, pacientes com demência avançada, déficits visuais ou auditivos graves. Outros possuem limitação transitória, como pacientes com
delirium
, sob sedação profunda ou vítimas de traumatismo cranioencefálico (TCE) grave.
Autorrelato
-
Escalas PQRSTUV, EAD e END:
- Atualmente, a minimização da sedação é uma das principais metas na UTI. Desse modo, mesmo pacientes intubados com nível de consciência adequado podem expressar a presença e intensidade da dor, por meio da busca ativa dos sintomas e do uso de escalas visuais. O autorrelato é fornecido pelo próprio paciente, se ele estiver desperto e não houver dificuldade para comunicação, sendo a melhor maneira de acessar a presença de dor. Nos pacientes conscientes, algumas informações valiosas devem ser obtidas desde o momento da admissão, como presença de dor crônica preexistente, dor relacionada com doença atual, diferentes características de ambas, e medicações de uso contínuo. Um meio de lembrar as informações que são necessárias perguntar é a ferramenta PQRSTUV.
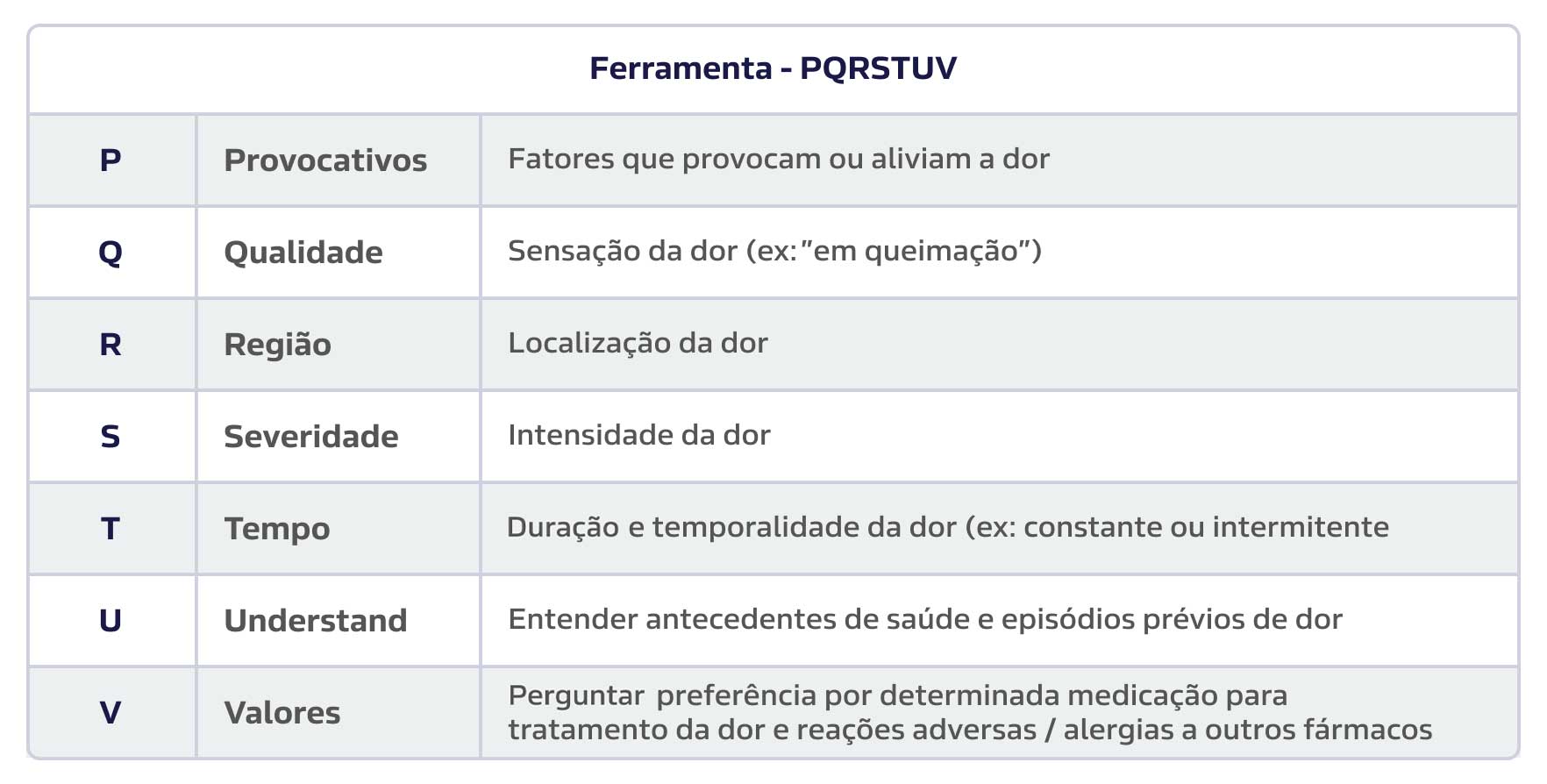 Figura 2:
Ferramenta PQRSTUV (lembrar da ordem alfabética das letras) para coleta de informações sobre as dores crônicas e agudas, apresentadas pelo paciente.
Figura 2:
Ferramenta PQRSTUV (lembrar da ordem alfabética das letras) para coleta de informações sobre as dores crônicas e agudas, apresentadas pelo paciente.
-
Escalas analógica e numérica de dor:
- Nos pacientes que se apresentem despertos, ainda que haja alguma barreira para a comunicação (ex.: intubação orotraqueal), podem-se utilizar escalas para medir a intensidade da dor e acompanhar sua resposta ao tratamento. Alguns exemplos são: a escala analógica de dor (EAD) e a escala numérica de dor (END).
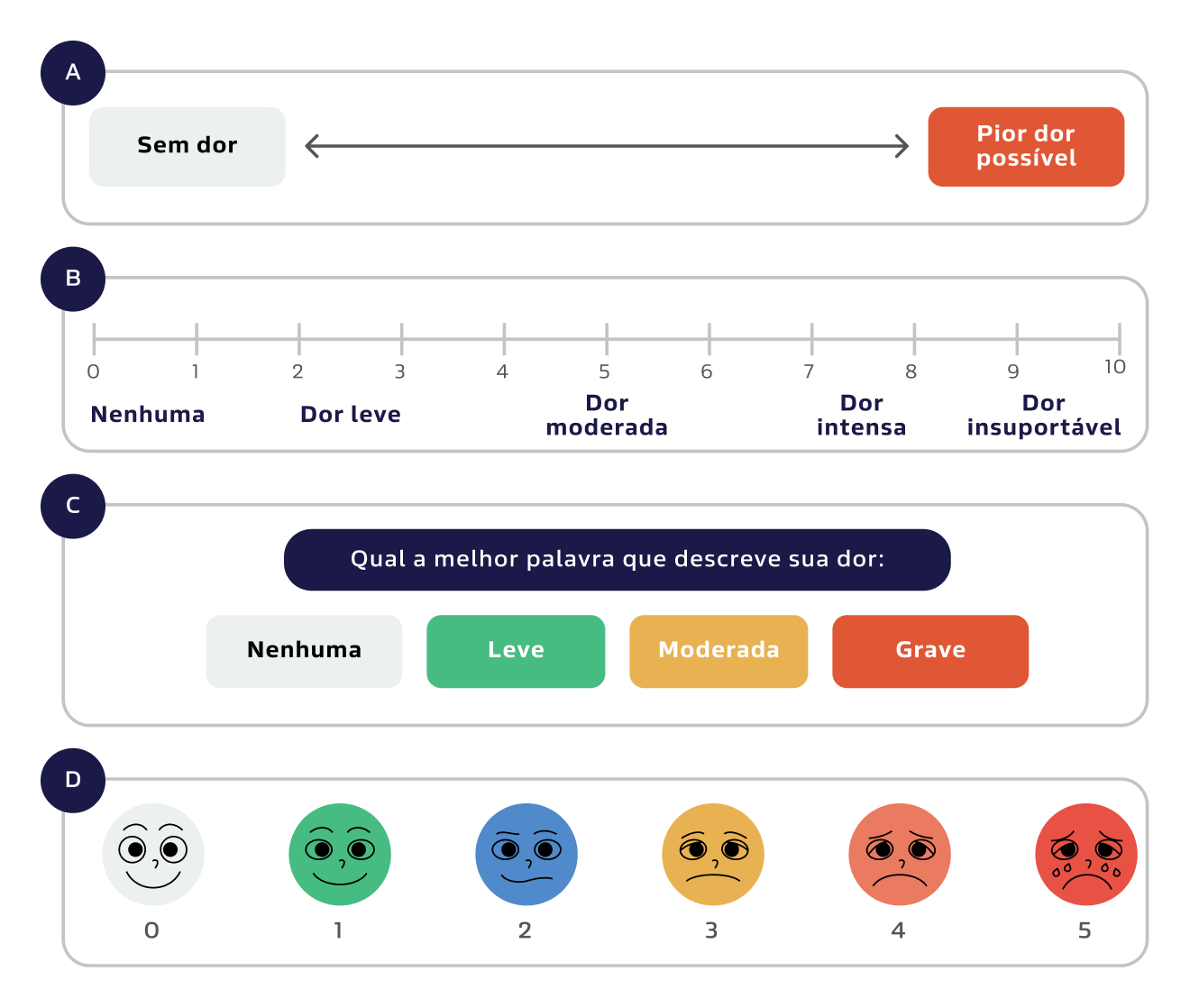 Figura 3:
Diferentes escalas para quantificar a intensidade da dor, de forma a acompanhar sua resposta ao tratamento, ao longo do tempo. A - Escala analógica de dor; B - Escala numérica de dor; C - Escala verbal de dor; D - Escala Facial de dor.
Figura 3:
Diferentes escalas para quantificar a intensidade da dor, de forma a acompanhar sua resposta ao tratamento, ao longo do tempo. A - Escala analógica de dor; B - Escala numérica de dor; C - Escala verbal de dor; D - Escala Facial de dor.
Escalas Comportamentais
-
Em pacientes com limitação importante para comunicação, é preciso utilizar escalas comportamentais de dor, como a CPOT e a BPS, demonstradas a seguir. A escala BPS original foi desenvolvida para aplicação em pacientes em intubação orotraqueal, porém conta com versões para pacientes não intubados (BPS-NI) e tem tradução validada para o português do Brasil. Ambas as escalas guiam a necessidade de tratamento com analgésicos, por meio de pontuações com valores estabelecidos, conforme indicado nas figuras 4 e 5.
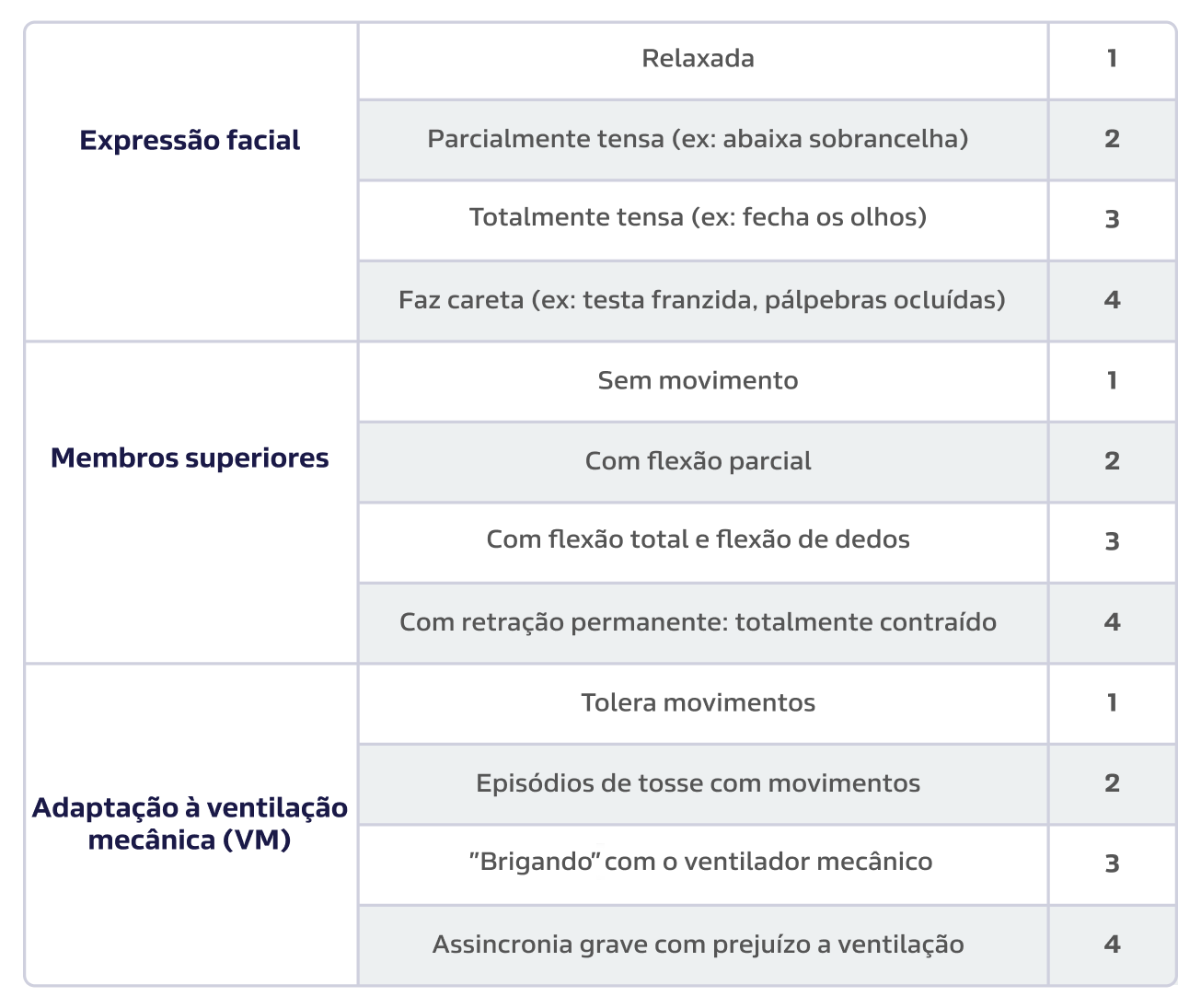 Figura 4:
Behavioral Pain Scale (BPS) adaptado para o português. A escala varia de 3 a 12 pontos e possui três domínios: expressão facial, movimentação de membros superiores e sincronia com o ventilador mecânico. Uma pontuação acima de 6 representa dor com necessidade de tratamento.
Figura 4:
Behavioral Pain Scale (BPS) adaptado para o português. A escala varia de 3 a 12 pontos e possui três domínios: expressão facial, movimentação de membros superiores e sincronia com o ventilador mecânico. Uma pontuação acima de 6 representa dor com necessidade de tratamento.
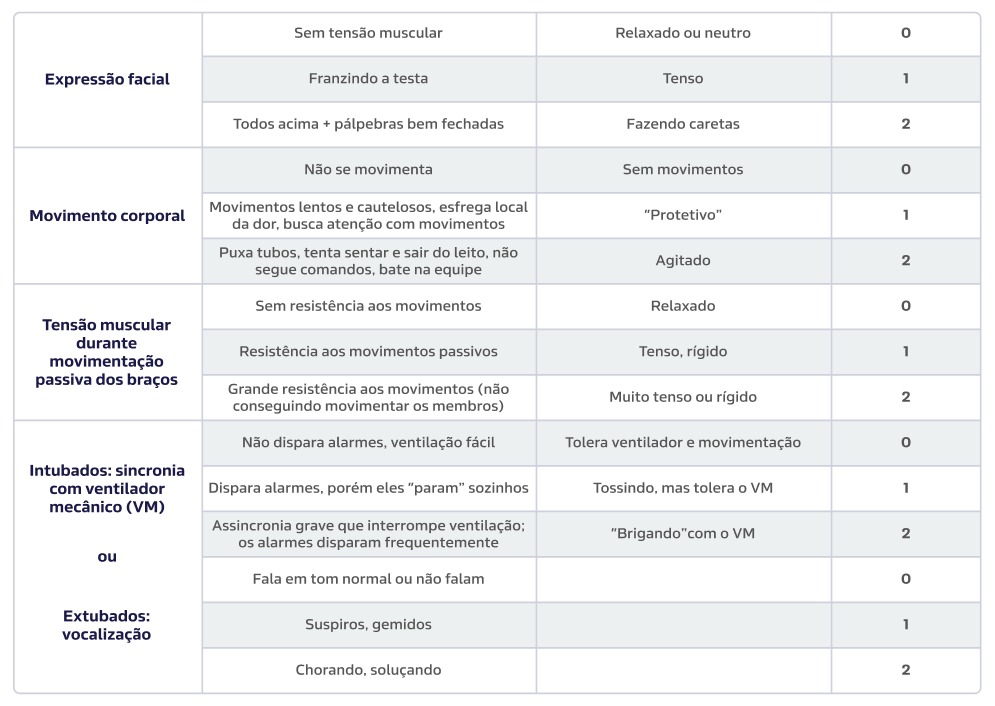 Figura 5:
Critical-Care Pain Observation Tool (CPOT). O escore varia de 0 a 8 pontos, com pontuações acima de 2 indicando um nível não aceitável de dor com necessidade de tratamento medicamentoso.
Figura 5:
Critical-Care Pain Observation Tool (CPOT). O escore varia de 0 a 8 pontos, com pontuações acima de 2 indicando um nível não aceitável de dor com necessidade de tratamento medicamentoso.
Perspectivas para o Futuro - A Avaliação Objetiva da Dor
Além dessas metodologias, novas tecnologias estão surgindo, para tornar mais objetiva e quantificável a avaliação da dor. A ideia é melhorar a avaliação de dor em pacientes com limitação para a comunicação (ex.: pacientes em coma). Ainda que estejam em desenvolvimento e devam ser mais bem estudadas, essas novas ferramentas
são descritas a seguir. Alguns exemplos são: o
Analgesia Nociception Index
® (ANI); o
Nociception Level
(NOL®); o
Pupillary Light Reflex
(PLR); o
Variation Coefficient of Pupillary Diameter
(VCPD); e o
Pupillary Pain Index
(PPI).
Analgesia Nociception Index® (ANI):
Ferramenta eletrofisiológica baseada na análise espectral da variabilidade da frequência cardíaca para estimar o tônus parassimpático, que tem relação com estímulos nociceptivos. O ANI varia de 0 (mínimo tônus parassimpático e máxima resposta ao estresse e dor) até 100 (máximo tônus parassimpático e mínima resposta ao estresse e dor). O estudo de validação do ANI o comparou com o BPS. Neste trabalho, a sensibilidade e a especificidade do ANI foram baixas. No entanto, o valor preditivo negativo do ANI > 43 foi de 90%. Assim, talvez esse índice seja adequado para a exclusão da presença de dor significativa.
Nociception Level (NOL®):
O NOL é um probe colocado no dedo do paciente, semelhante a um oxímetro, que quantifica o nível de resposta fisiológica do paciente à dor. Isso é feito por meio de quatro sensores que calculam dezenas de parâmetros fisiológicos relacionados ao estímulo nociceptivo. Os dados são analisados por algoritmos de inteligência artificial e convertidos a um único indicador numérico: o
Nociception Level Index
. Nesse índice, o número "0" significa ausência de dor, enquanto "100" representa dor extrema. Esse parâmetro pode ser visualizado por um monitor específico, o PMD200.
Índice de dor pela pupilometria (
Pupillary Pain Index
[PPI]
)
: O tamanho das pupilas reflete o balanço entre os sistemas simpático e parassimpático. Atualmente, estão disponíveis aparelhos chamados pupilômetros, que conseguem medir as pupilas de maneira acurada, com precisão de milímetros. Podem ser avaliados o reflexo de dilatação pupilar com estímulos nociceptivos, e o reflexo de constrição pupilar com estímulo luminoso. O grau de dilatação das pupilas, diante de um estímulo doloroso, pode estimar o grau de analgesia fornecido. O PPI é um novo índice, derivado da avaliação dos reflexos pupilares. Em vez de utilizar estímulos nociceptivos, são usados estímulos elétricos de intensidade variável, para avaliar a analgesia durante procedimentos cirúrgicos. O PPI varia de "1" (pouca reatividade pupilar, que significa alto grau de analgesia) até "10" (muita reatividade pupilar, representando baixo nível de analgesia).
Aplicativos para celular:
Existem aplicativos disponíveis para celular que visam facilitar a comunicação do paciente com a família e a equipe de saúde. O aplicativo gratuito Patient Communicator, desenvolvido pela
Society of Critical Care Medicine, tem
versão em português. Esse pode ser baixado no celular do paciente que apresenta limitações para comunicação (ex.: intubação orotraqueal), facilitando sua conversa com os familiares e a equipe multiprofissional.
A compreensão dos mecanismos subjacentes aos diferentes tipos de dor é fundamental para a seleção de tratamentos eficazes. A seguir, são detalhadas as respostas terapêuticas específicas para cada categoria de dor.
Analgesia Multimodal
A analgesia multimodal é uma abordagem que emprega múltiplos agentes analgésicos, cada um com diferentes mecanismos de ação, para proporcionar um controle da dor mais eficaz e reduzir a utilização de opioides. Além disso, são usados anestésicos regionais e intervenções não farmacológicas para melhorar o controle da dor.
Os opioides continuam sendo um pilar para o tratamento da dor na maioria dos ambientes de UTI. No entanto, há diversas preocupações de segurança relacionadas com seu uso, por exemplo: sedação,
delirium
, depressão respiratória, íleo, imunossupressão e dependência. Assim, um dos focos durante a abordagem da dor deve ser a de "poupar opioides".
-
São medidas não farmacológicas recomendadas para controle da dor:
- Massagem e liberação miofascial;
- Musicoterapia;
-
Compressas de gelo (ex.: antes de retirar drenos de tórax);
- Técnicas de relaxamento (ex.: meditação mindfulness, respiração profunda, tai chi, yoga, terapia cognitivo-comportamental).
-
São medicações recomendadas para redução do uso de opioides:
- Dor, em geral: Acetaminofeno, Dipirona, Cetamina em baixas doses;
- Dor neuropática: Gabapentina, Carbamazepina, Pregabalina;
-
Dor relacionada com procedimentos: anti-inflamatório não esteroides (AINEs) - pesar risco
versus
benefício.
Opções Terapêuticas
-
Dor nociceptiva:
- Exemplos: pós-operatório, procedimentos, trauma musculoesquelético;
- Combinação de AINEs, como Ibuprofeno ou Naproxeno, com Acetaminofeno é frequentemente eficaz. Também podem ser utilizados: Cetamina em baixas doses (0,5 mg/kg em bólus seguido de 1-2 microgramas/kg/minuto) e adjuvantes como Pregabalina, Gabapentina e Carbamazepina. Esses medicamentos podem ser complementados por anestesia regional ou bloqueios nervosos periféricos, para proporcionar alívio adicional da dor;
-
Opioides: indicados para dores de intensidade moderada a severa. Devem ser utilizados com cautela, seguindo uma abordagem escalonada (ex.: opioides fracos, como Tramadol, ou doses baixas de opioides fortes).
-
Dor neuropática:
- Exemplos: herpes-zóster, Guillain-Barré, traumatismo de nervos periféricos;
-
Associar anticonvulsivantes, como Gabapentina ou Pregabalina, e antidepressivos, como os inibidores da recaptação de serotonina e noradrenalina (IRSNs);
- Opioides: Tramadol e Metadona atuam na dor neuropática. Evitar demais opioides, por sua eficácia limitada nesse contexto.
-
Dor miofascial:
- Exemplo: contratura muscular;
-
Prioridade para intervenções não farmacológicas, como fisioterapia e técnicas de liberação miofascial.
-
Dor crônica:
- Exemplo: fibromialgia;
-
Integrar intervenções farmacológicas (ex.: Gabapentina, Pregabalina, antidepressivos tricíclicos e IRSNs) e não farmacológicas (ex.: terapia cognitivo-comportamental, meditação mindfulness).
Exemplos de Doses
-
Analgésicos comuns:
- Paracetamol (300 mg/3 mL) 500-1.000 mg VO a cada 4-6 horas (dose máxima: 6 g/dia);
- Dipirona sódica (500 mg/mL) 500-2.000 mg VO/EV de 6/6 horas (dose máxima: 8 g/dia).
-
Anti-inflamatórios não esteroidais (AINEs):
- Ibuprofeno (200 mg/comprimido) 200-800 mg VO até de 6/6 horas;
- Diclofenaco (50 mg/comprimido) 100-150 mg/dia VO divididos em 2-3x/dia (dose máxima: 150 mg/dia);
- Naproxeno (250 mg/comprimido) 250-500 mg/dose VO de 12/12 horas (dose máxima: 1.500 mg/dia);
- Indometacina (25 mg/comprimido) 50-200 mg/dia VO divididos em 2-4x/dia (dose máxima: 200 mg/dia);
- Cetoprofeno (100 mg/frasco) 50-100 mg VO/EV de 8/8 horas (dose máxima: 300 mg/dia);
- Piroxicam (40 mg/2 mL) 10-20 mg VO/EV de 12/12 ou 24/24 horas (dose máxima: 40 mg/dia);
- Celecoxibe (100-200 mg/comprimido) 100-200 mg VO de 12/12 horas (dose máxima: 400 mg/dia);
- Etoricoxibe (60 mg/comprimido) 60-90 mg VO/EV de 24/24 horas;
- Tenoxicam (20 mg/2 mL) 20-40 mg VO/EV de 24/24 horas (dose máxima: 40 mg/dia);
- Nimesulida (100 mg/comprimido) 50-100 mg VO de 12/12 horas;
- Meloxicam (15 mg/1,5 mL) 7,5-15 mg VO/IM a cada 12-24 horas. A dose IM não deve exceder 15 mg/dia.
-
Relaxantes musculares:
- Carisoprodol (125 mg/comprimido) 250-350 mg VO de 8/8 horas;
- Cloridrato de ciclobenzaprina (5 mg/comprimido) 5 mg VO em 2-4x/dia (dose máxima: 60 mg/dia);
- Baclofeno (10 mg/comprimido) 15 mg/dia VO de 8/8 horas (dose máxima: 80 mg/dia).
-
Opioides:
- Fosfato de codeína (30 mg/comprimido) 30-60 mg VO até de 4/4 horas;
- Cloridrato de tramadol (50 mg) 50-100 mg VO/EV até de 6/6 horas (dose máxima: 400 mg/dia);
- Morfina (10 mg/comprimido) dose inicial: 5-10 mg VO de 4/4 horas (dose usual: 15-30 mg VO de 4/4 horas);
- Morfina (0,1-10 mg/mL) 2-5 mg EV.
-
Medicações para dor neuropática:
- Amitriptilina (25 mg/comprimido) 65-100 VO mg/dia, por, no mínimo, 3 semanas;
- Nortriptilina (10 mg/comprimido) 10-50 mg/dia VO (idosos), com aumento a cada 3-5 dias até 160 mg/dia VO (adultos), ao deitar-se;
- Carbamazepina (200 mg/comprimido) 100-200 mg/dia VO até 1.200 mg/dia lentamente;
- Gabapentina (300 mg/comprimido) 300-1.800 mg/dia VO em 3 doses (aumento de 300 mg/dia);
- Pregabalina (75 mg/comprimido ou 150 mg/comprimido) 75 mg VO 2x/dia.
-
Autoria principal:
-
Bernardo Schwartz E. Mello (Cirurgia Plástica);
- Gabriela Queiroz (Anestesiologia).
Revisão: Mariana C. S. da Rocha (Anestesiologia).
Gélinas C, Shahiri TS, Richard-Lalonde M, et al. Exploration of a Multi-Parameter Technology for Pain Assessment in Postoperative Patients After Cardiac Surgery in the Intensive Care Unit: The Nociception Level Index (NOL)TM. J Pain Res. 2021 Dec 7; 14:3723-3731.
Nordness MF, Hayhurst CJ, Pandharipande P. Current Perspectives on the Assessment and Management of Pain in the Intensive Care Unit. J Pain Res. 2021 Jun 14; 14:1733-1744.
Gélinas C, Bérubé M, Puntillo KA, et al. Validation of the Critical-Care Pain Observation Tool-Neuro in brain-injured adults in the intensive care unit: a prospective cohort study. Crit Care. 2021 Apr 13; 25(1):142.
Shahiri TS, Richard-Lalonde M, Richebé P, et al. Exploration of the Nociception Level (NOL™) Index for Pain Assessment during Endotracheal Suctioning in Mechanically Ventilated Patients in the Intensive Care Unit: An Observational and Feasibility Study. Pain Manag Nurs. 2020 Oct; 21(5):428-434.
Vinclair M, Schilte C, Roudaud F, et al. Using Pupillary Pain Index to Assess Nociception in Sedated Critically Ill Patients. Anesth Analg. 2019 Dec; 129(6):1540-1546.
Devlin JW, Alhazzani W. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU (PADIS). Crit Care Med. 2018 Sep; 46(9):e825-e873.
Chanques G, Tarri T, Ride A, et al. Analgesia nociception index for the assessment of pain in critically ill patients: a diagnostic accuracy study. Br J Anaesth. 2017 Oct 1; 119(4):812-820.
Vincent JL, Shehabi Y, Walsh TS, et al. Comfort and patient-centred care without excessive sedation: the eCASH concept. Intensive Care Med. 2016 Jun; 42(6):962-971.
Morete, MC. Tradução e adaptação cultural da versão portuguesa (Brasil) da escala de dor Behavioural Pain Scale. Rev. bras. ter. intensiva 2014; 26(4): 373-378.
Paulus J, Roquilly A, Beloeil H, et al. Pupillary reflex measurement predicts insufficient analgesia before endotracheal suctioning in critically ill patients. Crit Care. 2013 Jul 24; 17(4):R161.
Payen JF, Isnardon S, Lavolaine J, et al. La pupillométrie en anesthésie-réanimation [Pupillometry in anesthesia and critical care]. Ann Fr Anesth Reanim. 2012 Jun; 31(6):e155-e159.
Loeser JD, Treede RD. The Kyoto protocol of IASP Basic Pain Terminology. Pain. 2008 Jul 31; 137(3):473-477.
Gélinas C, Fillion L, Puntillo KA, et al. Validation of the critical-care pain observation tool in adult patients. Am J Crit Care. 2006 Jul; 15(4):420-427.
Payen JF, Bru O, Bosson JL, et al. Assessing pain in critically ill sedated patients by using a behavioral pain scale. Crit Care Med. 2001 Dec; 29(12):2258-2263.