ECMO Veno-venosa
Definição: A oxigenação por membrana extracorpórea (ECMO, do inglês Extracorporeal Membrane Oxygenation) é caracterizada pela oxigenação e remoção do gás carbônico (CO 2 ) através da passagem do sangue por um circuito extracorpóreo.
- Em pacientes com hipercapnia refratária ou síndrome do desconforto respiratório agudo (SDRA) grave com hipoxemia, as taxas de mortalidade variam de 45-90%, dependendo da definição de refratariedade;
- Atualmente, a circulação extracorpórea como suporte respiratório é uma modalidade de resgate, com uso restrito às situações de hipoxemia refratária ou quando existe risco do suporte ventilatório necessário agravar a lesão pulmonar (ex.: elevadas pressões de platô);
- O principal objetivo dessa terapia é manter a troca respiratória (oxigenação e ventilação) do paciente, possibilitando uma ventilação mecânica (VM) protetora/ ultraprotetora, de forma a fornecer tempo hábil para a recuperação pulmonar da causa base da insuficiência respiratória.
- Na ECMO veno-venosa (VV), habitualmente, o sangue é drenado da veia cava inferior do paciente através de uma cânula de drenagem e passa por meio da membrana de oxigenação, na qual ocorre a troca de oxigênio e gás carbônico. Em seguida, através da cânula de devolução, o sangue retorna próximo ao átrio direito, onde se mistura com o fluxo venoso sistêmico. Essa mistura de sangue passa pelos pulmões, onde realizará nova troca gasosa e retorna para as câmaras cardíacas esquerdas;
- Para realizar o transporte de sangue pela ECMO utilizamos uma bomba centrífuga acoplada ao sistema, sendo necessário o ajuste das rotações por minuto (RPM) da ECMO e, por consequência, o fluxo de sangue. Além disso, deve-se ajustar o fluxo de gás ( sweep ), que passará através da membrana de oxigenação para ajustar a retirada de CO 2 sanguíneo;
- O oxigenador promove trocas gasosas pelo princípio da difusão. O gás "fresco", rico em oxigênio e sem CO 2 , atravessa uma membrana respiratória (polimetilpenteno) em contrafluxo ao fluxo de sangue venoso. A remoção de CO 2 do sangue é extremamente eficaz (16-20 vezes mais eficaz que a difusão de oxigênio), dependendo principalmente do fluxo de gás pela membrana ( sweep ), além do fluxo sanguíneo. No entanto, a transferência de oxigênio é mais complicada, pois depende do fluxo sanguíneo e da capacidade total de transporte de oxigênio do sangue (determinada pela hemoglobina). De uma forma simplificada, ao aumentarmos o fluxo de sangue pela ECMO aumentamos a sua oxigenação.
- Cânula venosa (drenagem);
- Cânula arterial (devolução);
- Bomba centrífuga;
- Hand crank (bomba manual);
- Membrana de oxigenação extracorpórea;
- Console;
- Aquecedor;
- Blender (FiO 2 da membrana de oxigenação);
- Fluxômetro (ajuste de sweep ).
-
ECMO veno-venosa (suporte respiratório) (figura 1):
- Preferimos a configuração veno-venosa para suporte respiratório. Nela, o oxigenador está em série com os pulmões nativos. Dessa forma, a função residual dos pulmões permanece importante para a oxigenação sistêmica.
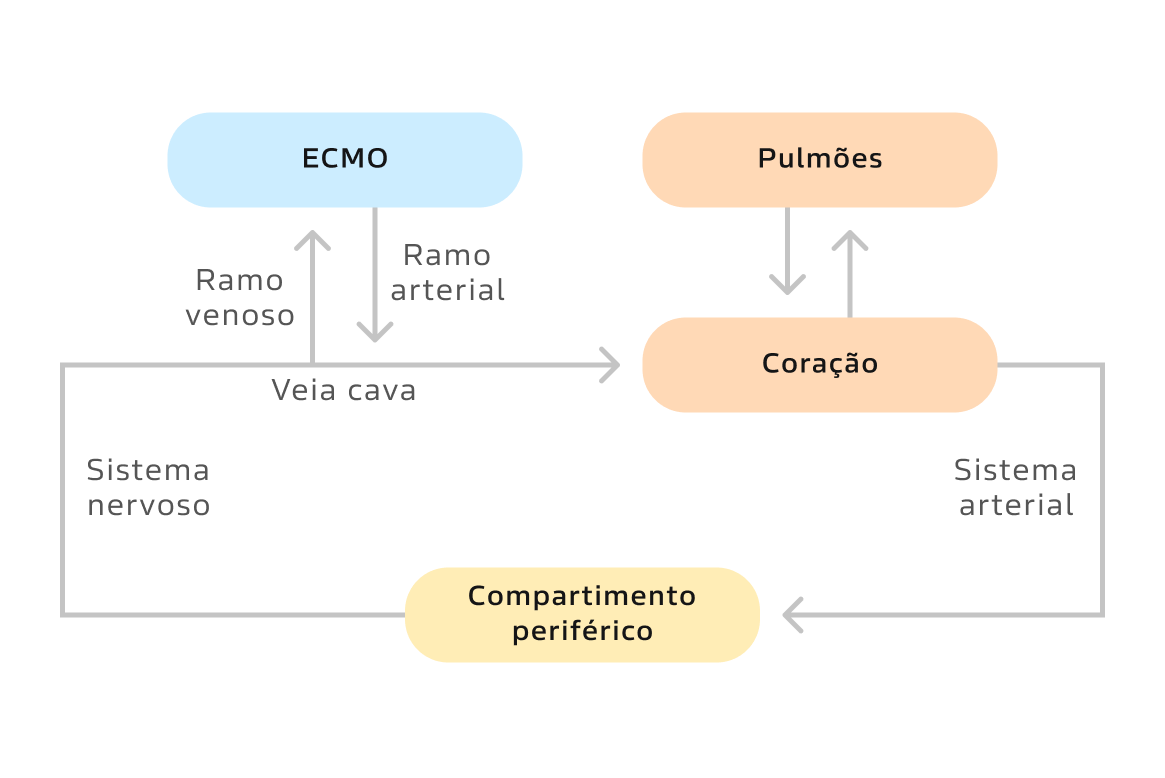 Figura 1. Ilustração:
Julia Fragale
Figura 1. Ilustração:
Julia Fragale
-
ECMO veno-arterial (suporte circulatório e respiratório) (figura 2):
- Nesta configuração o oxigenador está em paralelo com pulmões, fornecendo suporte respiratório e circulatório para o paciente.
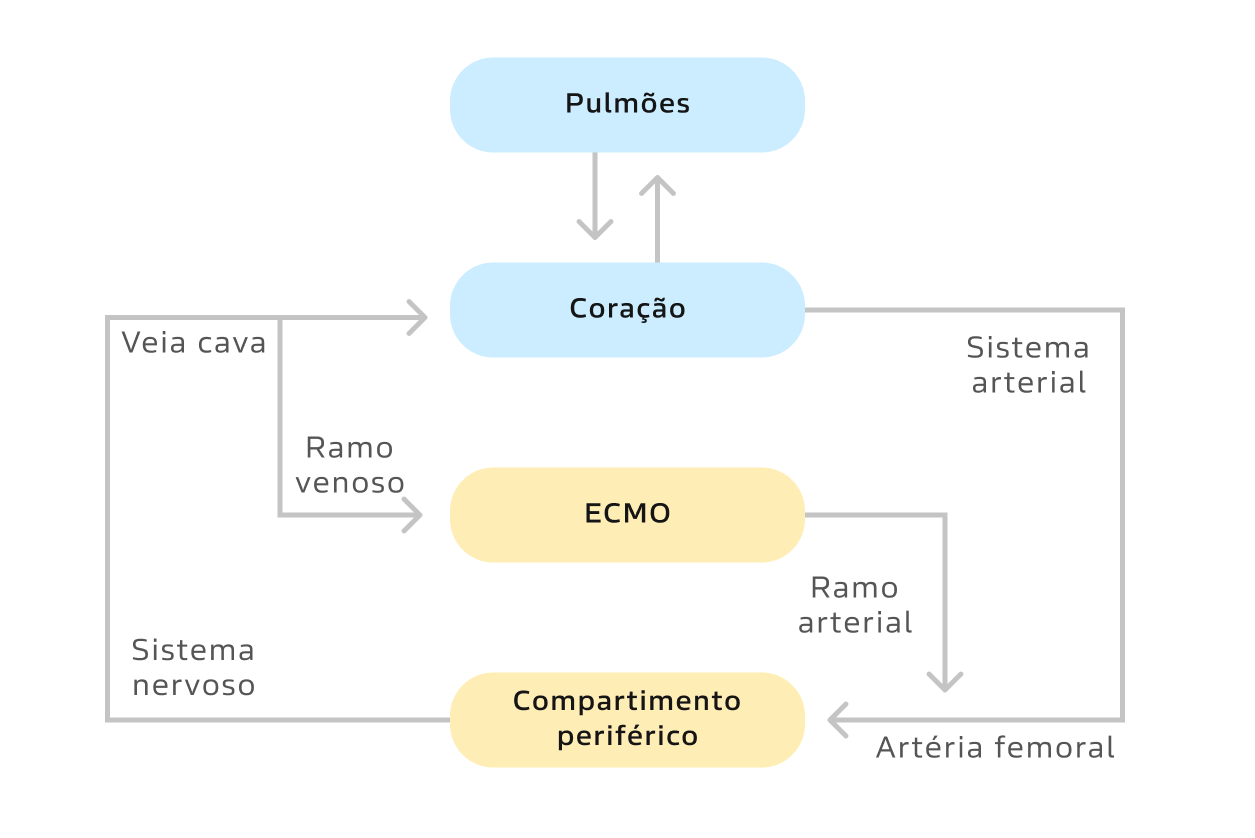 Figura 2. Ilustração:
Julia Fragale
Figura 2. Ilustração:
Julia Fragale
- Ajustar RPM e fluxo de sangue para SatO 2 > 85%;
- Ajustar fluxo de sweep para um pH > 7.3 e normocapnia;
-
Ventilação mecânica protetora/ ultraprotetora:
- Modo PCV ou VCV;
- VC 3-6 mL/kg com pressão de platô < 20-25 cmH 2 O;
- PEEP: 10-15 cmH 2 O;
- FR: 10-15 rpm;
- FiO2: 30% ou a menor necessária.
- Anticoagulação: é necessária para evitar a formação de coágulos no sistema de ECMO, além de prevenir a trombose vascular nos locais de inserção das cânulas, evitando, assim, uma disfunção do oxigenador, hemólise, e embolia pulmonar;
- Checklist do circuito em vários momentos do plantão para detecção precoce de complicações e ajuste de suporte.
-
Pacientes com SDRA com < 7 dias de ventilação mecânica otimizada (FiO
2
> 80% , VC 6 mL/kg, PEEP > 10 cmH
2
O) e um dos seguintes critérios:
- Relação PaO 2 / FiO 2 < 50, por > 3 horas;
- Relação PaO 2 / FiO 2 < 80, por > 6 horas;
- pH < 7,25 + PaCO 2 > 60 mmHg, por > 6 horas;
- Quadro refratário a outras terapias de resgate, como bloqueador neuromuscular e posição prona.
-
Absoluta:
- A única contraindicação absoluta para não iniciar a ECMO é quando não há expectativa de recuperação do paciente (pulmonar e/ou sistêmica) e não há um plano viável para decanulação. Isso pode ocorrer devido à gravidade da doença de base (ex.: neoplasia pulmonar metastática, fibrose pulmonar irreversível) ou por disfunção de múltiplos órgãos instalada (choque séptico refratário).
-
Relativas:
- Hemorragia ou lesão irreversível do sistema nervoso central;
- Hemorragia sistêmica não controlada;
- Contraindicação à anticoagulação;
- Imunossupressão;
- Idade avançada (idade não definida, podendo ser considerado o conceito de fragilidade);
- Ventilação mecânica por mais de 7 dias com pressão de platô > 30 cmH 2 O e FiO 2 > 90%.
Podemos utilizar o
Respiratory ECMO Survival Prediction
(RESP)
Score
para obter informações prognósticas que podem ser usadas para ajudar na seleção de pacientes. Este escore é facilmente acessível pela internet no website do
RESP Score
.
- Hemorragia;
- Trombose do circuito e das cânulas;
- Disfunção do oxigenador;
- Chicoteamento da cânula venosa e queda do fluxo de sangue;
- Embolia aérea (circuito venoso pré-bomba centrífuga tem pressão negativa facilitando entrada de ar);
- Decanulação acidental;
- Falha de bomba (ex.: queda de energia).
Autoria principal:
Yuri de Albuquerque (Medicina Intensiva).
Revisão:
Vinicius Zofoli (Medicina Intensiva).
-
Equipe adjunta:
- Rafael Arruda Alves (Emergencista com especialidade em Emergência Pediátrica e Medicina Intensiva).
Romano TG, Mendes PV, Park M, et al. Extracorporeal respiratory support in adult patients. J Bras Pneumol. 2017; 43(1):60-70.
Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet. 2009; 374(9698):1351-63.
Combes A, Hajage D, Capellier G, et al. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med. 2018; 378(21):1965-1975.
Tonna JE, Abrams D, Brodie D, et al. Management of Adult Patients Supported with Venovenous Extracorporeal Membrane Oxygenation (VV ECMO): Guideline from the Extracorporeal Life Support Organization (ELSO). ASAIO J. 2021; 67(6):601-610.
Schmidt M, Bailey M, Sheldrake J, et al. Predicting survival after extracorporeal membrane oxygenation for severe acute respiratory failure. The Respiratory Extracorporeal Membrane Oxygenation Survival Prediction (RESP) score. Am J Respir Crit Care Med. 2014; 189(11):1374-82.