Coronavírus (Covid-19) - Laboratório
Definição: O novo coronavírus (SARS-CoV-2) é um betacoronavírus de material genético RNA de sentido positivo não segmentado e envelopado, membro de uma grande família viral, que pode cursar com quadros de doenças respiratórias de gravidade variável em humanos. Sua transmissão se dá de pessoa para pessoa, seja por contato direto ou por meio de secreções/superfícies contaminadas (ex.: respiratória, fezes).
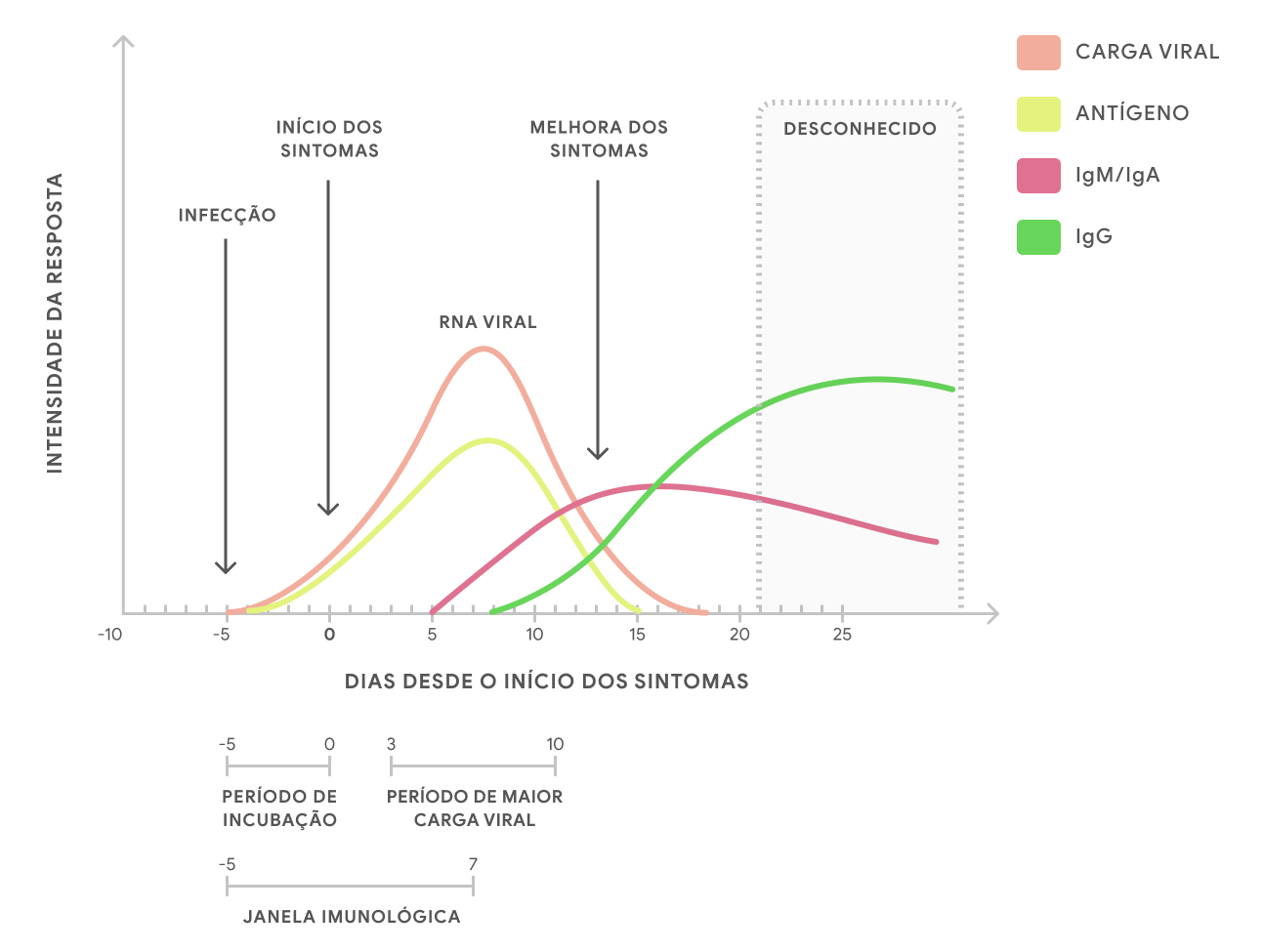
O novo coronavírus apresenta período de incubação que pode variar de 2 a 14 dias (média de 5 dias). A transmissibilidade dos pacientes infectados é de até 7 dias, em média, a partir do início dos sintomas (a depender, dentre outros fatores, da gravidade da doença). Todavia, a transmissão pode ocorrer mesmo em pacientes assintomáticos.
-
RT-PCR (teste molecular "padrão-ouro"):
- A identificação viral se dá pela reação em cadeia da polimerase com transcrição reversa em tempo real (RT-PCR) para a detecção in vitro , em amostras de secreções respiratórias do trato superior ou inferior, apresentando uma alta sensibilidade e especificidade;
-
Resumidamente, essa técnica avalia a amplificação de alguns marcadores/alvos (ex.: gene RdRP, gene N, gene E) do genoma viral, segundo o protocolo original Charité. Outros protocolos também são utilizados, com algumas variações entre si;
- Essa foi a primeira metodologia validada, desde o início da pandemia, para o diagnóstico da Covid-19, sendo considerada a padrão-ouro para o diagnóstico da infecção, principalmente nos pacientes sintomáticos em fase aguda. Tecnologias fundamentadas em testes rápidos moleculares, que podem fornecer resultados em menos de uma hora, além de outras variações de metodologias moleculares (ex.: RT-LAMP), também se encontram disponíveis comercialmente;
-
A coleta pode ser realizada precocemente, já na identificação da suspeita clínico-epidemiológica, no início dos primeiros sinais e sintomas. A amostra deverá ser coletada até o 12
o
dia dos sintomas (preferencialmente entre o terceiro e o sétimo dias, período de maior eliminação viral pelas vias aéreas);
-
Essa janela de detecção pode variar de acordo com o material biológico utilizado. Casos de detecção prolongada do material genético têm sido observados, notadamente, em materiais de via aérea inferior e/ou em infecções graves. Nesses casos, entretanto, a persistência da positividade pode estar relacionada apenas a detecção de fragmentos de material genético de vírus não viáveis/infectantes.
-
Teste rápido de antígeno:
- Esses testes detectam diretamente alguns antígenos virais (ex.: antígeno N - nucleocapsídeo), através da coleta ( swab ) de secreções respiratórias das vias aéreas superiores. Técnicas como a imunofluorescência e "testes rápidos" por imunocromatografia podem ser utilizadas para identificação desses antígenos;
-
De maneira geral, apresentam um bom desempenho analítico (sensibilidade de 85-90% e especificidade próxima de 100%) quando comparados ao método molecular de referência (RT-PCR). Entretanto, seu valor preditivo negativo (VPN) não é muito alto, ou seja, frente a um resultado negativo, principalmente, mas não exclusivamente, em pacientes com alta suspeição clínica, um método molecular em outra amostra deve ser realizado para confirmação do resultado;
-
Assim como na RT-PCR, esse exame deve ser realizado em pacientes na fase aguda da infecção (preferencialmente entre o terceiro e o sétimo dias). Pode ser útil para ajudar no diagnóstico precoce dos pacientes, notadamente em localidades com acesso difícil ao RT-PCR, bem como auxiliar na decisão sobre o isolamento social dos casos positivos;
- Os chamados "autotestes" (modelo de teste em que o próprio paciente coleta, processa e interpreta o resultado), também se baseiam na detecção dos antígenos virais, e estão amplamente disponíveis.
-
Outros ensaios:
- O teste imunológico imunocromatográfico ("teste rápido sorológico") foi adotado inicialmente pelo Ministério da Saúde (MS) como uma das estratégias, ao lado do teste molecular, para o auxílio diagnóstico da Covid-19. Entretanto, no momento, está em desuso devido ao surgimento de metodologias mais sensíveis e específicas, além do aumento da disponibilidade dos testes moleculares e de antígeno. Ele detecta qualitativamente os anticorpos IgM e IgG no sangue, que são proteínas específicas produzidas pela resposta imunológica à infecção pelo novo coronavírus. A detecção dos anticorpos IgM, com maior sensibilidade, se dá a partir do sétimo ao décimo dia do início dos sintomas (podendo permanecer detectáveis por semanas a alguns meses), seguida, classicamente, pela elevação dos títulos de IgG a partir do décimo ao 18 o dia (permanecendo detectáveis por um período prolongado, ainda não muito bem definido). Todavia, a dinâmica da produção e detecção desses anticorpos pode variar. Apresenta simplicidade de operação e interpretação analítica, custo menor, não necessita de equipamentos complementares e o seu resultado pode estar disponível em torno de 15 minutos;
-
Estão largamente disponíveis outros métodos imunológicos com a capacidade de detectar qualitativamente, semi-quantitativamente e quantitativamente os títulos de anticorpos IgA/IgM/IgG, por meio de plataformas analíticas convencionais, baseadas nas técnicas de ensaio imunoadsorvente ligado à enzima (ELISA), eletroquimioluminescência e quimioluminescência, por exemplo. Eles podem detectar, separada ou conjuntamente (anticorpos totais), os diferentes tipos de imunoglobulinas presentes na amostra. Essas metodologias, performadas dentro do ambiente do laboratório clínico, em aparelhos robustos e automatizados, apresentam um melhor desempenho analítico quando comparadas aos "testes rápidos" imunocromatográficos, embora ainda apresentem um baixo valor preditivo negativo (VPN) - inferior a 50% - nos primeiros sete dias de doença. Desse modo, sua coleta somente é recomendada a partir do sétimo ao décimo dia do início dos sintomas;
- Também existem alguns ensaios qualitativos para a detecção de anticorpos neutralizantes totais. Os anticorpos neutralizantes são um subgrupo de anticorpos ligantes, que possuem a capacidade de bloquear (neutralizar) a interação entre o agente e a célula hospedeira. Na Covid-19, esses anticorpos inibem a ligação entre o domínio de ligação ao receptor (RBD, do inglês receptor-binding domain ) localizado na subunidade S1 da proteína S ( spike ) do SARS-CoV-2, e o receptor da enzima conversora da angiotensina 2 (ACE2) na superfície da membrana da célula-alvo. Partindo da premissa que os vírus são parasitas intracelulares obrigatórios, ao impedir essa ligação entre o vírus e a célula-alvo, a endocitose e posterior replicação viral são inibidas. Embora ainda não haja uma recomendação formal de seu uso, além de não ter se estabelecido uma correlação concreta entre a resposta humoral com a imunidade, esse ensaio possui potencial para se avaliar a história de contato prévio ou a eficácia e imunogenicidade das vacinas. A maioria dos fabricantes de kits diagnósticos aprovados, estabelece um cut-off (ponto de corte) de 30%. Ou seja, acima de 30% é considerado como presença de anticorpos neutralizantes, enquanto que resultados inferiores a 30% são indicativos da ausência desses anticorpos.
Outras alterações laboratoriais mais comuns incluem linfocitopenia, aumento da proteína C-reativa e de outros reativos de fase aguda, bem como de outros marcadores (ex.: ferritina ), leucocitose ou leucopenia, elevação de D-dímeros , aumento do LDH total , da TGP/ALT e do fibrinogênio ). Recomenda-se a pesquisa concomitante de outros patógenos respiratórios - agentes etiológicos relacionados às infecções respiratórias endêmicas mais comuns - por meio de painéis virais moleculares disponíveis em alguns laboratórios clínicos.
-
Indicações (RT-PCR e teste rápido de antígeno):
- Pacientes hospitalizados com síndrome respiratória aguda grave (SRAG);
- Indivíduos na fase aguda, com síndrome gripal (SG);
- Triagem em pacientes assintomáticos;
- Amostragem e monitoramento de casos (vigilância epidemiológica);
- Comprovação da doença em óbitos a esclarecer que possuíam suspeita clínica-epidemiológica.
-
Como solicitar:
- Teste molecular: RT-PCR para SARS-CoV-2; RT-PCR para covid-19.
- Teste rápido de antígeno: Teste de antígeno; teste de antígeno do SARS-CoV-2; teste de antígeno para covid-19.
| Teste Molecular | Teste Rápido de Antígeno | |
| Metodologia | RT-PCR | Imunocromatografia |
| Sumário | Técnica padrão-ouro para o diagnóstico, capaz de detectar o material genético (RNA) viral | Teste imunocromatográfico qualitativo, que detecta alguns antígenos virais (ex.: nucleocapsídeo) |
| Vantagens |
Elevada sensibilidade/ especificidade;
primeira metodologia validada para o diagnóstico |
Custo mais baixo;
não necessita de infraestrutura laboratorial; liberação rápida de resultados; Point-of-Care Testing ( POCT) |
| Desvantagens |
Alto custo;
elevada complexidade; necessidade de equipamentos e insumos especializados; maior tempo para liberação dos resultados |
Desempenho analítico um pouco inferior ao dos testes moleculares |
| Material | Secreções respiratórias |
Secreções respiratórias
|
| Sensibilidade | 63-92% na fase aguda, a depender do material biológico | 85-90% (quando comparados ao método molecular de referência) |
| Especificidade | Próximo de 100% | Próximo de 100% |
| Indicações |
Pacientes hospitalizados com síndrome respiratória aguda grave (SRAG);
indivíduos na fase aguda, com síndrome gripal (SG); triagem em pacientes assintomáticos; amostragem e monitoramento de casos (vigilância epidemiológica); comprovação da doença em óbitos a esclarecer |
Pacientes hospitalizados com síndrome respiratória aguda grave (SRAG); indivíduos na fase aguda, com síndrome gripal (SG); triagem em pacientes assintomáticos; amostragem e monitoramento de casos (vigilância epidemiológica); comprovação da doença em óbitos a esclarecer |
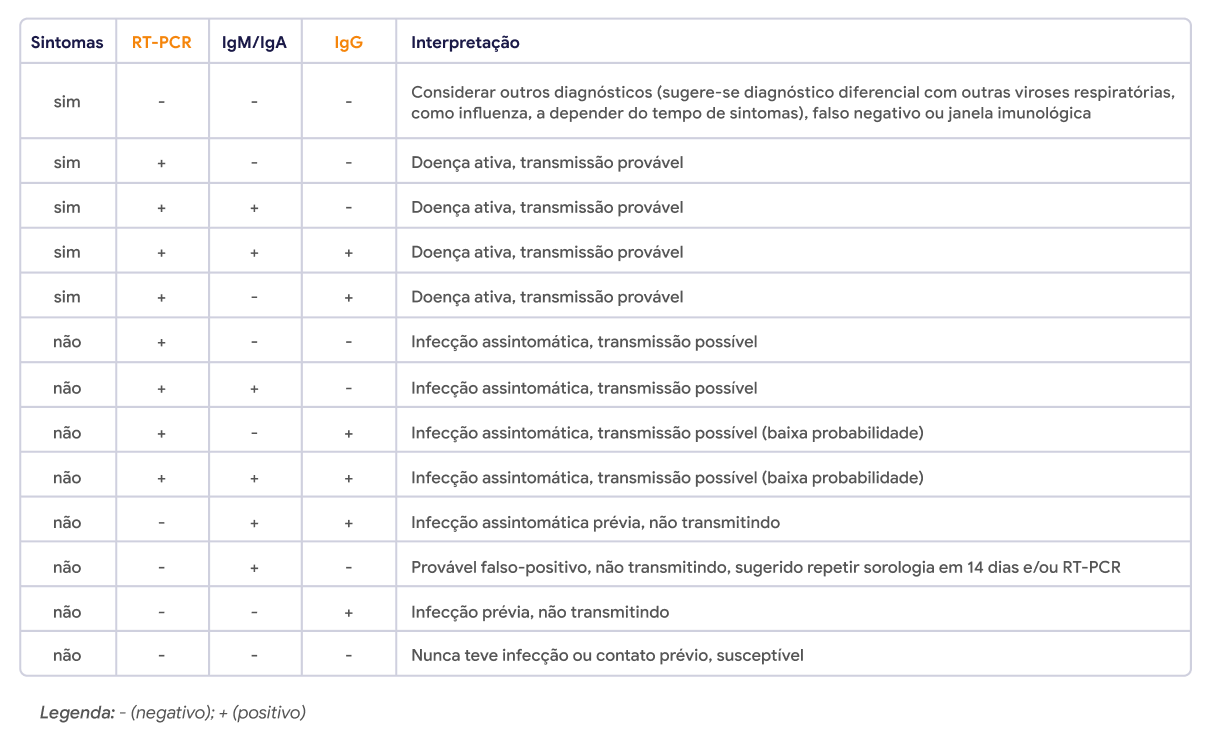 Dias V, et al. Testes sorológicos para COVID-19: Interpretação e aplicações práticas. J. Infect. Control, 2020 Abr-Jun; 9(2).
Dias V, et al. Testes sorológicos para COVID-19: Interpretação e aplicações práticas. J. Infect. Control, 2020 Abr-Jun; 9(2).
- Orientações ao paciente: o jejum não é necessário, e a coleta pode ser realizada em qualquer hora do dia. Para coletas do trato respiratório superior, assoar o nariz em papel/lenço descartável, a fim de diminuir a quantidade de muco/pus. Informar que a inserção do swab nas narinas pode gerar algum desconforto, bem como ânsia de vômito durante a coleta da secreção de orofaringe;
-
Precauções:
deve ser realizada a precaução padrão, de contato e respiratória, para coleta de material respiratório, com o uso adequado dos equipamentos de proteção individual (EPI). Para mais informações sobre EPI no contexto da Covid-19, acesse conteúdo específico sobre o tema;
-
Trato respiratório superior (
swab
de naso e/ou orofaringe):
- Secreção nasofaríngea: não utilizar swab com hastes de madeira ou que contenham alginato de cálcio. Com o paciente com a cabeça levemente inclinada para trás, introduzir delicadamente o swab com movimentos rotatórios em uma narina. Deve-se margear o palato, até atingir a resistência da parede posterior da nasofaringe, deixando-o absorver as secreções por alguns segundos, retirando-o em seguida. Com o mesmo swab , repetir o procedimento na outra narina. Logo em seguida, colocá-lo em um frasco estéril contendo meio de transporte universal viral (UTM) ou com 2-3 mL de solução fisiológica 0,9% estéril. Mantê-lo resfriado de 2-8 o C;
- Secreção orofaríngea: não utilizar swab com hastes de madeira ou que contenham alginato de cálcio. Com o paciente de boca aberta, utilizando um abaixador de língua e um foco de luz para auxílio, introduzir o swab até a faringe posterior, evitando tocar na úvula e nas amígdalas. Logo em seguida, colocá-lo em um frasco estéril contendo meio de transporte universal viral (UTM) ou com 2-3 mL de solução fisiológica 0,9% estéril. Mantê-lo resfriado de 2-8 o C;
- Aspirado/lavado nasofaríngeo ou aspirado nasal: com o cateter conectado ao sistema de sucção, orientar o paciente a permanecer com a cabeça levemente inclinada para trás. Instilar 1-1,5 mL de solução salina bacteriostática em uma narina, e inserir de modo paralelo ao palato. Deve ser introduzido a uma profundidade igual à distância entre uma narina e o orifício externo do ouvido. Removê-lo com movimentos rotatórios delicados. Logo em seguida, colocá-lo em um frasco estéril contendo meio de transporte universal viral (UTM) ou com 2-3 mL de solução fisiológica 0,9% estéril. Mantê-lo resfriado de 2-8 o C.
-
Trato respiratório inferior:
- Lavado broncoalveolar, aspirado traqueal, fluido pleural ou biópsia pulmonar: Coletar 2-3 mL do material em recipiente estéril, estanque e com tampa de rosca. Mantê-lo resfriado de 2-8 o C;
- Escarro: s olicitar ao paciente para expectorar a secreção obtida por meio de uma tosse profunda, coletando 2-3 mL do material em recipiente estéril com boca larga e tampa de rosca. Mantê-lo resfriado de 2-8 o C. A indução de escarro não é recomendada.
- Armazenamento: o material pode ser armazenado até a sua análise laboratorial por até 72 horas após a coleta, se mantido resfriado de 2-8 o C. Se houver suspeita que sua chegada e processamento pelo laboratório de apoio/referência se estenda por mais de 72 horas, o material deve ser congelado a -70 o C ou menos;
-
Material:
- RT-PCR: s ecreção de naso e/ou orofaringe, saliva, aspirado/lavado nasofaríngeo, aspirado nasal, lavado broncoalveolar, aspirado traqueal ou escarro.
-
Volume recomendável:
- Trato respiratório superior ( swab de naso e/ou orofaringe, saliva, aspirado/lavado nasofaríngeo, aspirado nasal) : não há um volume recomendável para esse tipo de coleta;
- Trato respiratório inferior (lavado broncoalveolar, aspirado traqueal, fluido pleural, biópsia pulmonar ou escarro): 2-3 mL.
-
Observações:
- A indução do escarro não é recomendada;
- As formas de coleta, os materiais e o armazenamento podem variar de acordo com cada laboratório clínico executante e kit diagnóstico. Recomenda-se entrar previamente em contato para informações específicas.
RT-PCR: Não detectado.
Teste rápido de antígeno: Não detectado.
-
RT-PCR:
- Um resultado negativo não exclui completamente a possibilidade de infecção;
- Apresenta, relativamente, um baixo VPN em pacientes assintomáticos e na fase de convalescença (a partir do décimo dia de sintomas);
-
Apresenta alta especificidade (próxima a 100%), porém sua sensibilidade pode variar de 63-92%, dependendo do tipo de amostra biológica coletada e da fase da doença. Amostras do trato respiratório inferior apresentam uma maior sensibilidade quando comparadas às do trato superior;
-
O tipo de amostra biológica utilizada, a contaminação ou coleta inadequada, o período da coleta e a oscilação da carga viral durante os vários estágios de evolução da doença podem influenciar na detecção do material genético do SARS-CoV-2;
-
Coletas muito precoces ou muito tardias em relação à evolução da infecção (fora do período de maior carga viral) podem apresentar resultados falso-negativos;
-
Se um paciente com alta suspeita clínico-epidemiológica da infecção apresentar um resultado negativo, outros materiais (preferencialmente do trato respiratório inferior) devem ser coletados para uma investigação adicional, especialmente se apenas amostras do trato respiratório superior tiverem sido coletadas no início da investigação;
-
Esse teste detecta, a depender do protocolo utilizado, a presença de três marcadores relacionados ao SARS-CoV-2. Resultados inconclusivos/indeterminados podem ser reportados se apenas um ou dois marcadores forem amplificados;
- Resultados falso-negativos e falso-positivos, embora raros, podem ocorrer, o que é uma característica do método;
- Apresenta um custo maior e necessita de insumos, pessoal e equipamentos especializados. Seus resultados podem ser disponibilizados em um período de tempo que varia de poucas horas a alguns dias (dependendo da demanda, logística e capacidade de processamento do laboratório);
- Assim como em outros testes moleculares, mutações nos genes-alvo da amplificação, a presença de inibidores e degradação do RNA viral podem afetar a sensibilidade do método.
-
Teste rápido de antígeno:
- Um resultado negativo não exclui completamente a possibilidade de infecção;
-
Resultados falso-negativos e falso-positivos, embora raros, podem ocorrer, o que é uma característica do método;
- Reações fracamente reagentes ao visual devem ser interpretadas como positivas;
-
Deve ser realizado e interpretado por profissional habilitado, vinculado a um laboratório clínico;
- Há uma extensa disponibilidade de kits diagnósticos disponíveis, que podem apresentar desempenhos analíticos distintos;
-
Apresenta alta especificidade (próxima a 100%), porém sua sensibilidade pode variar de 85-90% quando comparada ao método de referência (RT-PCR);
-
O tipo de amostra biológica utilizada, a contaminação ou coleta inadequada, o período da coleta e a oscilação da carga viral durante os vários estágios de evolução da doença podem influenciar na detecção do antígeno do SARS-CoV-2;
-
Coletas muito precoces ou muito tardias em relação à evolução da infecção (fora do período de maior carga viral) podem apresentar resultados falso-negativos;
-
Se um paciente com alta suspeita clínico-epidemiológica da infecção apresentar um resultado negativo, recomenda-se uma outra testagem por metodologia molecular para confirmar o resultado.
Autoria principal: Pedro Serrão Morales (Patologia Clínica e Medicina Laboratorial).
Associação Médica Brasileira (AMB). CEM COVID_AMB, Boletim 18/2021: testagem rápida e efetividade no combate a Covid-19. [Internet]. (Acesso em 24 mar 2023).
Agência Nacional de Vigilância Sanitária (ANVISA). Resolução de Diretoria Colegiada 595 de 28 de janeiro de 2022, que dispõe sobre os requisitos e procedimentos para a solicitação de registro, distribuição, comercialização e utilização de dispositivos médicos para diagnóstico in vitro como autoteste para detecção de antígeno do SARS-CoV-2, em consonância ao Plano Nacional de Expansão da Testagem para Covid-19 (PNE-Teste), e dá outras providências. 2022. [Internet]. (Acesso em 25 mar 2023).
CDC (Centers for Disease Control and Prevention). Interim Infection Prevention and Control Recommendations for Patients with Confirmed Coronavirus Disease 2019 (COVID-19) or Persons Under Investigation for COVID-19 in Healthcare Settings. [Internet]. CDC. Clifton Road Atlanta, GA: CDC. (Accessed on March 25, 2023).
CDC (Centers for Disease Control and Prevention). Interim Guidelines for COVID-19 Antibody Testing. [Internet]. CDC. Clifton Road Atlanta, GA: CDC. (Accessed on March 25, 2023).
CDC (Centers for Disease Control and Prevention). Interim Guidelines for Collecting and Handling of Clinical Specimens for COVID-19 Testing. [Internet]. CDC. Clifton Road Atlanta, GA: CDC. (Accessed on March 25, 2023).
CDC (Centers for Disease Control and Prevention). Interim Laboratory Biosafety Guidelines for Handling and Processing Specimens Associated with Coronavirus Disease 2019 (COVID-19). [Internet]. CDC. Clifton Road Atlanta, GA: CDC. (Accessed on March 25, 2023).
CDC ( Centers for Disease Control and Prevention). Overview of Testing for SARS-CoV-2, the virus that causes COVID-19. [Internet]. CDC. Clifton Road Atlanta, GA: CDC. (Accessed on March 25, 2023).
CDC (Centers for Disease Control and Prevention). Research Use Only Real-Time RT-PCR Protocol for Identification of 2019-nCoV. [Internet]. CDC. Clifton Road Atlanta, GA: CDC. (Accessed on March 25, 2023).
Corman VM, et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020; 25(3).
GenScript. cPass™ SARS-CoV-2 Neutralization Antibody Detection Kit. [Internet]. GenScript USA Inc. Centennial Ave. Piscataway, NJ: GenScript USA Inc. (Accessed on March 25, 2023).
European Commission. Current performance of COVID-19 test methods and devices and proposed performance criteria - Working document of Commission services. [Internet]. European Commission. (Accessed on March 25, 2023).
Dias V. Testes sorológicos para COVID-19: Interpretação e aplicações práticas. J Infect Control. 2020; 9(2).
ECO F COVID nAb. ECO Diagnóstica LTDA. Versão 003/2020. Bula de fabricante.
Fan W. Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. Shanghai Public Health Clinical Center and Key Laboratory of Medical Molecular Virology (MOE/NHC/CAMS), School of Basic Medical Sciences, Fudan University, Shanghai, China. [Internet]. (Accessed on March 25, 2023).
Fruehwirth M, Rivas AV, Fitz AFR, et al. Resultado falso negativo no diagnóstico molecular de SARS-CoV-2 em amostras com inibidores de amplificação. J Bras Patol Med Lab. 2020; 56(1):1-8.
Grupo Força Colaborativa COVID-19 Brasil. Orientações sobre Diagnóstico, Tratamento e Isolamento de Pacientes com COVID-19. Versão 01. [Internet]. ACM. Florianópolis, SC: ACM. (Acesso em 25 mar 2023).
IchromaTM COVID-19 nAb. Boditech Med Incorporated. BL3755 - REV01 - 03/2021. Bula de fabricante.
Lippi G, Simundic AM, Plebani M. Potential preanalytical and analytical vulnerabilities in the laboratory diagnosis of coronavirus disease 2019 (COVID-19). Clin Chem Lab Med. 2020; 58(7):1070-1076.
Meyer B, Drosten C, Muller MA. Serological assays for emerging coronaviruses: challenges and pitfalls. Virus Res. 2014; 194:175-83.
Ministério da Saúde (BR). Guia de Vigilância Epidemiológica Covid-19: Emergência de Saúde Pública de Importância Nacional pela Doença pelo Coronavírus 2019. Versão 4. Brasília: Ministério da Saúde, 2020.
Ministério da Saúde (BR). Secretaria de Vigilância em Saúde (SVS). Plano Nacional de Expansão da Testagem para a Covid-19 | PNE-Teste. Testa Brasil. Secretaria de Vigilância em Saúde (SVS) / Departamento de Imunização e Doenças Transmissíveis (DEIDT/SVS). 2a ed. Brasília: Ministério da Saúde, 2022.
Ministério da Saúde (BR). Protocolo de Tratamento do Novo Coronavírus.Brasília: Ministério da Saúde, 2020.
Novel Coronavirus (Covid-19) Autoteste Antígeno. Bioscience (Tianjin) Diagnostic Technology Co.; Ltd. Bula de fabricante.
Pan American Health Organization. Interim laboratory biosafety guidelines for the handling and transport of samples associated with the novel coronavirus 2019 (2019-nCoV). [Internet]. PAHO. Washington, DC: PAHO.(Accessed on March 25, 2023).
Pan American Health Organization. Laboratory Guidelines for the Detection and Diagnosis of COVID-19 Virus Infection. [Internet]. PAHO. Washington, DC: PAHO.(Accessed on March 25, 2023).
Sethuraman N, Jeremiah SS, Ryo A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA - J Am Med Assoc. 2020; 323(22):2249-2251.
Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Diagnóstico Laboratorial da Infeccção pelo Novo Coronavírus (COVID-19). Posicionamento Oficial da Sociedade de Patologia Clínica/Medicina Laboratorial (SBPC/ML). [Internet]. Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Rio de Janeiro, RJ: Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. (Acesso em 25 mar 2023).
Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Métodos Laboratoriais para Diagnóstico da Infecção pelo SARS-CoV-2. Recomendações da Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial (SBPC/ML). [Internet]. Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Rio de Janeiro, RJ: Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. (Acesso em 25 mar 2023).
Wang Q, Du Q, Guo B, et al. A Method To Prevent SARS-CoV-2 IgM False Positives in Gold Immunochromatography and Enzyme-Linked Immunosorbent Assays. 2020; 58(6):1-7.
World Health Organization. WHO policy brief: COVID-19 surveillance, 11 April 2023. [Internet]. WHO. Geneva: WHO. (Accessed on March 25, 2023).
World Health Organization. Global surveillance for COVID-19 disease caused by human infection with the 2019 novel coronavirus. [Internet]. WHO. Geneva: WHO. (Accessed on March 25, 2023).
World Health Organization. Laboratory testing for coronavirus disease 2019 (COVID-19) in suspected human cases: interim guidance, 2 March 2020. [Internet]. WHO. Geneva: WHO. (Accessed on March 25, 2023).
Yan G, Lee CK, Lam LTM, et al. Covert COVID-19 and false-positive dengue serology in Singapore. Lancet Infect Dis. 2020; 20(5):536.
Zhang Y-Z. Novel 2019 coronavirus genome. [Internet]. Virological.org. (Accessed on March 25, 2023).
Zhao J, Yuan Q, Wang H, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020; 71(16):2027-2034.