Eletroforese de Lipoproteínas
Definição: T écnica de separação e quantificação relativa (%) das lipoproteínas séricas de acordo com sua mobilidade eletroforética.
Sinônimos:
Eletroforese de Lipoproteínas com Gráfico; Lipoproteinograma Eletroforético; Eletroforese de Frações de Lipoproteínas; Eletroforese de Lipoproteínas Séricas; Eletroforese de Lipoproteínas - Sangue.
Os lipídios são substâncias com pouca solubilidade e, dessa forma, circulam pelo plasma combinados às lipoproteínas (complexos macromoleculares circulantes), que os transportam para os tecidos nos quais irão desempenhar suas funções metabólicas.
Na eletroforese de lipoproteínas, os padrões dos traçados encontrados são úteis para auxiliar na caracterização das dislipidemias. Assim como a eletroforese de proteínas séricas , trabalha-se com um pH alcalino de 8,6 utilizando um corante específico para lipídios.
-
Dependendo de sua mobilidade eletroforética, as lipoproteínas podem ser classificadas de:
- Origem: Q (quilomícron), que está presente na origem da eletroforese;
- Padrão intermediário: Pré-beta lipoproteína de muito baixa densidade (VLDL, do inglês v ery low-density lipoprotein ) e lipoproteína a [Lp(a)] , que se deslocam com as alfa-2-globulinas;
- Padrão beta larga (não ocorre separação entre pré-beta e beta) : Lipoproteína de densidade intermediária (IDL, do inglês i ntermediate density lipoprotein) ;
-
Beta:
Lipoproteína de baixa densidade (LDL, do inglês
l
ow-density lipoprotein
),
que migra com a fração das betaglobulinas;
- Alfa: Lipoproteína de alta densidade (HDL, do inglês high-density lipoprotein ), que migra na região das alfa-1-globulinas.
As lipoproteínas deslocam-se pelo meio de suporte (o mais utilizado é o gel de agarose, mas também pode ser usado, por exemplo, o de papel ou a poliacrilamida) em velocidades na ordem de HDL > VLDL > LDL. Já os Qs, se detectados na amostra, ficam retidos na origem.
Na disbetalipoproteinemia tipo III, partículas de IDL formam uma banda larga entre as regiões pré-beta e beta.
A eletroforese de lipoproteínas pode ser complementada com outros métodos (como, apesar de sua não praticidade, da ultracentrifugação analítica) para uma melhor interpretação dos resultados.
Indicações:
Auxílio diagnóstico e caracterização das dislipidemias primárias e secundárias.
Como solicitar:
Eletroforese de Lipoproteínas.
- Orientações ao paciente: Jejum de 12 horas (alguns laboratórios clínicos dispensam a necessidade do jejum);
- Tubo para soro (tampa vermelha/amarela). Após a devida retração do coágulo, centrifugar a amostra por 15 minutos e manter o material sob refrigeração (2 a 8°C);
- Material: Sangue;
-
Volume recomendável:
1 mL.
 Figura 1.
Tubo para soro - tampa vermelha -
Ilustração:
Caio Lima.
Figura 1.
Tubo para soro - tampa vermelha -
Ilustração:
Caio Lima.
 Figura 2.
Tubo para soro - tampa amarela -
Ilustração:
Caio Lima.
Figura 2.
Tubo para soro - tampa amarela -
Ilustração:
Caio Lima.
- HDL: 23 a 46%;
- VLDL: 3 a 18%;
-
LDL: 42 a 63%.
Observação!
Os valores de referência para a eletroforese de lipoproteínas podem variar de acordo com o Laboratório Clínico e a metodologia utilizada.
Algumas lipoproteínas, como a Lpx, podem ser subestimadas (elas são coradas fracamente por serem ricas em fosfolipídios e colesterol livre).
Algumas frações análogas, comparadas quando submetidas à eletroforese e à ultracentrifugação, podem se comportar de maneira diferente (ex: beta-VLDL, Lp(a) ).
A eletroforese de lipoproteínas não é necessária para o diagnóstico da maioria das dislipoproteinemias.
Amostras acentuadamente hemolisadas podem prejudicar o resultado do exame.
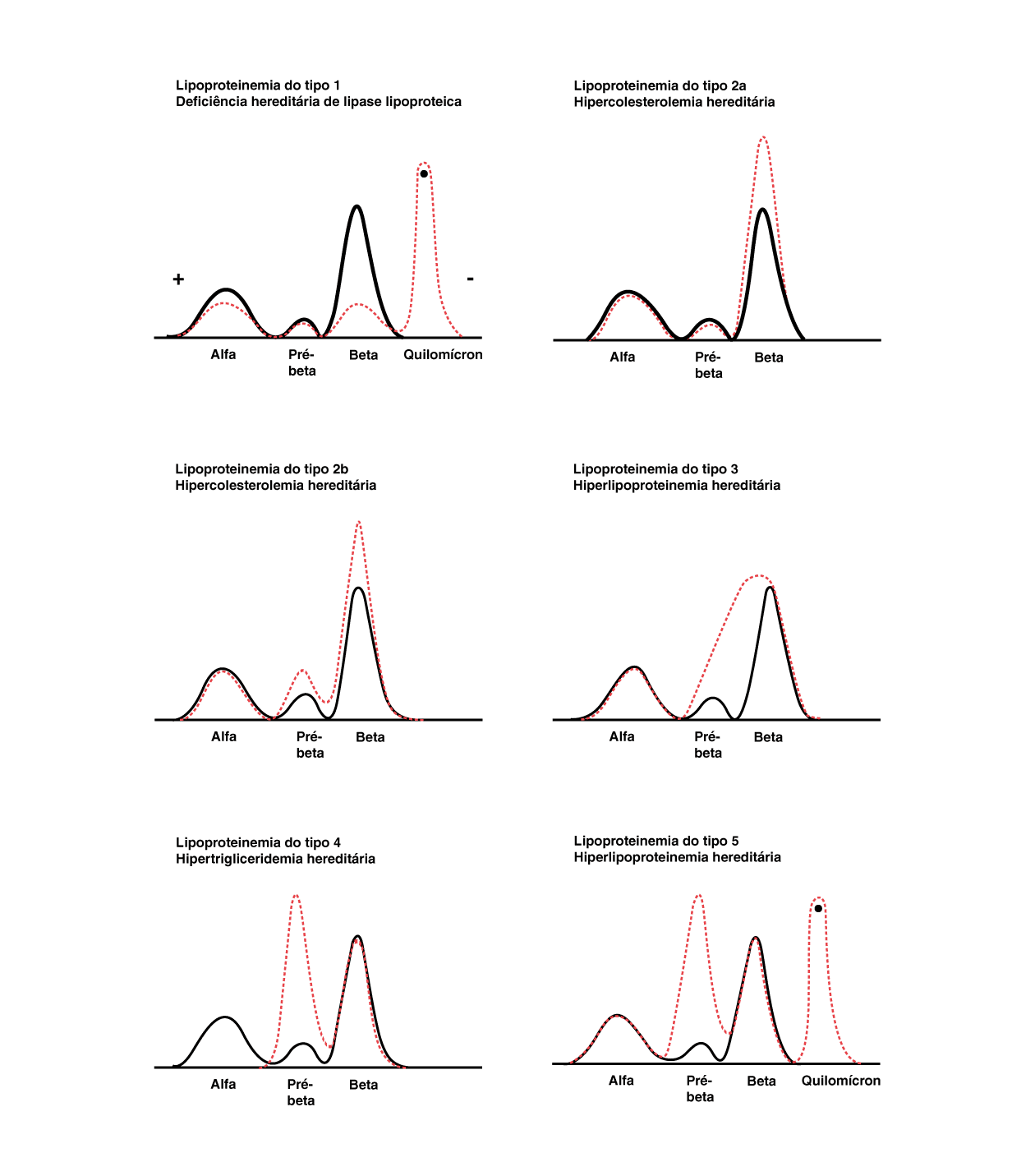 Figura 1.
Adaptada de
: Naoum, 1999.
Figura 1.
Adaptada de
: Naoum, 1999.
Autoria principal: Pedro Serrão Morales (Patologia Clínica e Medicina Laboratorial).
März W, Scharnagl H, Kleber M, et al. Labordiagnostik von Fettstoffwechselstörungen. [Laboratory diagnostics of lipid metabolism disorders]. Dtsch Med Wochenschr. 2023; 148(23):e120-46.
Chang YH, Lin DY, Tsai CL, et al. Management of patients with type V hyperlipoproteinemia: an uncommon phenotype of dyslipidemia with chylomicronemia and severe hypertriglyceridemia. J Pers Med. 2022; 13(1):68.
Kanaan S, Garcia MAT, Xavier AR, eds. Bioquímica clínica. 3. ed. Rio de Janeiro, RJ: Atheneu; 2022.
Ćwiklińska A, Mickiewicz A, Kowalski R, et al. Detection of lipoprotein X (LpX): a challenge in patients with severe hypercholesterolaemia. J Med Biochem. 2020; 39(3):283-9.
Kanaan S. Laboratório com interpretações clínicas. Rio de Janeiro, RJ: Atheneu; 2019.
McPherson RA, Pincus MR. Henry's clinical diagnosis and management by laboratory methods. 23rd ed. St. Louis, MO: Elsevier; 2017.
Campos EM. Da classificação dos fenotipos de Fredrickson - perfis das lipoproteínas ao entendimento dos genotipos. [From Fredrickson's classification of phenotypes--lipoprotein patterns--to genotype comprehension]. Acta Med Port. 2005; 18(3):189-98.
Blom DJ, Byrnes P, Jones S, et al. Non-denaturing polyacrylamide gradient gel electrophoresis for the diagnosis of dysbetalipoproteinemia. J Lipid Res. 2003; 44(1):212-7.
Jacobs DS, DeMott WR, Oxley DK, eds. Jacobs & DeMott laboratory test handbook with key word index. 5th ed. Hudson, OH: Lexi-Comp Inc.; 2001.
Naoum PC. Eletroforese - técnicas e diagnósticos. 2. ed. São Paulo, SP: Livraria Santos Editora; 1999.
Nauck M, Winkler K, März W, et al. Quantitative determination of high-, low-, and very-low-density lipoproteins and lipoprotein(a) by agarose gel electrophoresis and enzymatic cholesterol staining. Clin Chem. 1995; 41:1761-7.
Sparks DL, Phillips MC. Quantitative measurement of lipoprotein surface charge by agarose gel electrophoresis. J Lipid Res. 1992; 33(1):123-30.